Três ensaios clínicos em andamento de ELEVIDYS (delandistrogene moxeparvovec-rokl), uma terapia genética desenvolvida pela Sarepta e comercializada pela Roche, foram temporariamente interrompidos pela Agência Europeia de Medicamentos (EMA). Esta notícia esperada, mas não indesejada, causou profunda tristeza na comunidade da distrofia muscular de Duchenne (DMD).
Os ensaios clínicos interrompidos incluem o estudo de fase 3 Envision, patrocinado pela Sarepta, que está avaliando Elevidys em meninos de 8 a 17 anos; o estudo de fase 2 Envol da Roche, que está investigando Elevidys em bebês e recém-nascidos; e o Estudo 104 da Sarepta, uma análise de fase 1 de Elevidys em meninos de 4 a 9 anos com anticorpos preexistentes para um sorotipo específico.
Antes de Roche, Sarepta e EMA, a primeira comunidade a publicar este anúncio foi nosso parceiro turco >>> DMD Dayanisma.
Roche emitiu uma carta à comunidade que você pode ler aqui.PDF)
Índice
Por que os ensaios clínicos do Elevidys foram interrompidos?
Após a morte de um garoto de 16 anos com distrofia muscular de Duchenne que recebeu uma infusão de Elevidys em 18 de março de 2025, a perspectiva para a terapia genética, que é comercializada a um preço comercial de $3 milhões, mudou abruptamente.Ler mais)
Até que a causa precisa da morte de um adolescente dos EUA que desenvolveu insuficiência hepática aguda (ALF) após tomar Elevidys possa ser determinada, a Agência Europeia de Medicamentos (EMA) solicitou que os estudos fossem suspensos. Quando o paciente faleceu no mês passado, a Sarepta declarou que alteraria o rótulo do Elevidys para incluir o sinal de segurança.
SRP-9001-104 Temporariamente Interrompido
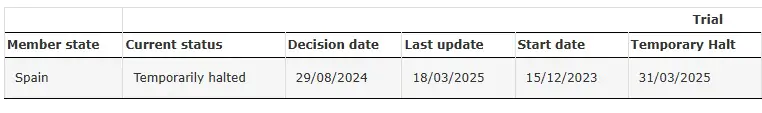
Fonte: Ensaio clínico do SRP-9001-104
ENVOL (Estudo 302) Interrompido Temporariamente
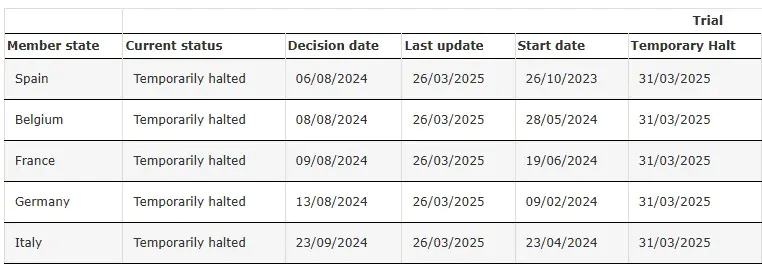
Fonte: Ensaio clínico do SRP-9001-302
SRP-9001-303 Temporariamente Interrompido
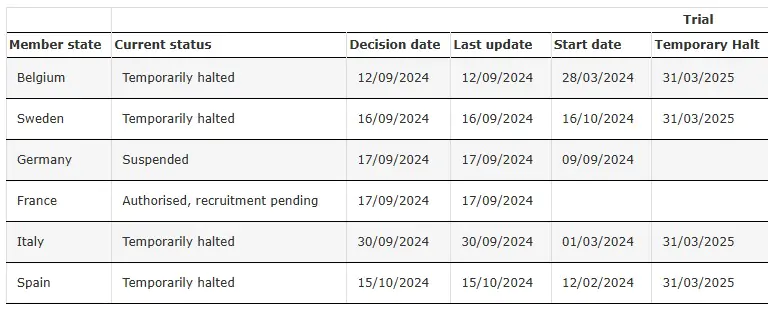
Fonte: Ensaio clínico do SRP-9001-303
Saber mais: O representante turco do DMD WarrioR compartilha suas opiniões sobre a terapia genética Elevidys.



https://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-provides-update-elevidys
Sarepta Therapeutics fornece atualização (de segurança) sobre ELEVIDYS
04/04/25 8:44 AM EDT
CAMBRIDGE, Mass.–(BUSINESS WIRE)–4 de abril de 2025– Sarepta Therapeutics, Inc. (NASDAQ:SRPT), líder em medicina genética de precisão para doenças raras, compartilhou a seguinte atualização relacionada ao ELEVIDYS (delandistrogene moxeparvovec-rokl), a única terapia genética aprovada em pacientes com distrofia muscular de Duchenne.
Após a atualização de segurança sobre insuficiência hepática aguda emitida em 18 de março, as autoridades do país membro de referência da União Europeia (UE) solicitaram que o comitê independente de monitoramento de dados (DMC) se reunisse para revisar o evento adverso. Enquanto a análise está sendo finalizada, o recrutamento e a dosagem em certos estudos clínicos do ELEVIDYS estão temporariamente interrompidos.
O DMC independente se reuniu em 3 de abril e concordou que, com base na totalidade das evidências, o perfil geral de risco-benefício permanece favorável para continuar a dosagem nos ensaios clínicos pausados sem alterações nos protocolos do estudo. A pedido dos reguladores da UE, a Sarepta e a Roche enviarão essas informações em uma resposta à interrupção temporária dentro de uma semana. A avaliação da submissão e a decisão subsequente para suspender a interrupção temporária seguirão o processo regulatório da UE.
Os estudos clínicos afetados pela interrupção temporária são o Estudo SRP-9001-302 (ENVOL), Estudo SRP-9001-303 (ENVISION) e Estudo SRP-9001-104. O monitoramento e a coleta de dados para participantes já inscritos continuam, e não prevemos um impacto material no cronograma desses estudos.
As ações caíram no mercado de ações.
https://dmdwarrior.com/dmd-warriors-turkish-representative-shares-his-views-on-elevidys-gene-therapy-is-it-effective-and-why-is-it-expensive/