ELEVIDYS(delandistrogene moxeparvovec-rokl)是一种由 Sarepta 开发、罗氏公司销售的基因疗法,目前正在进行的三项临床试验已被欧洲药品管理局暂时叫停(EMA)。这一意料之中但并非不受欢迎的消息让杜氏肌营养不良症 (DMD) 患者群体深感悲痛。
暂停的试验包括 Sarepta 资助的 3 期 Envision 研究,该研究正在评估 8 至 17 岁男孩的 Elevidys;罗氏的 2 期 Envol 研究,该研究正在研究婴儿和新生儿的 Elevidys;以及 Sarepta 的 104 研究,这是一项 1 期研究,针对 4 至 9 岁已存在特定血清型抗体的男孩的 Elevidys。
在 Roche、Sarepta 和 EMA 之前,第一个发布此公告的社区是我们的土耳其合作伙伴 >>> DMD Dayanisma.
罗氏公司向社区发出了一封信,您可以在此处阅读。(PDF)
目录
Elevidys临床试验为何停止?
2025年3月18日,一位患有杜氏肌营养不良症的16岁男孩在接受Elevidys输注后死亡,这一商业售价为$3百万美元的基因疗法的前景突然发生改变。阅读更多)
一位美国青少年在服用 Elevidys 后出现急性肝功能衰竭 (ALF),在查明其确切死因之前,欧洲药品管理局 (EMA) 要求暂停研究。上个月患者去世后,Sarepta 宣布将修改 Elevidys 的标签,以加入安全信号。
SRP-9001-104 暂时停止
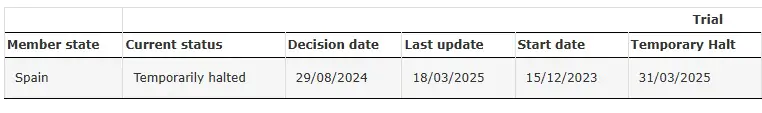
来源: SRP-9001-104临床试验
ENVOL(研究 302)暂时停止
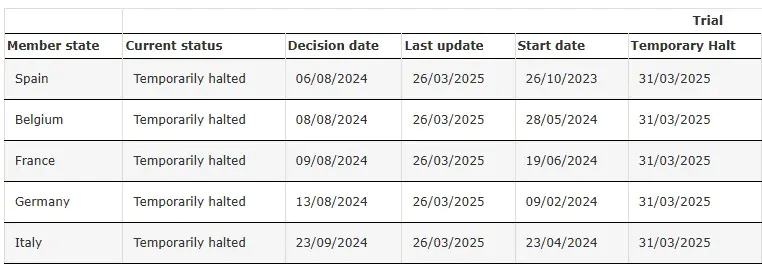
来源: SRP-9001-302临床试验
SRP-9001-303 暂时停止
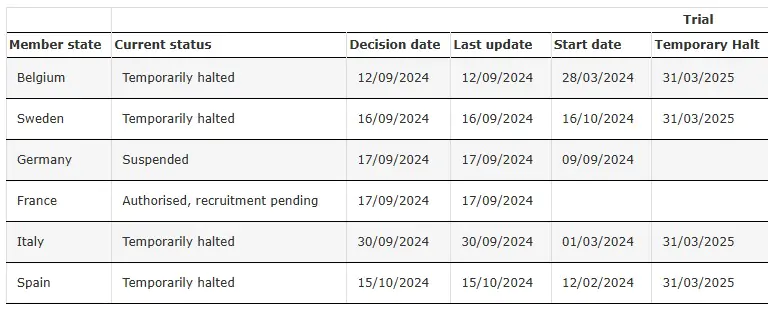



https://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-provides-update-elevidys
Sarepta Therapeutics 提供 ELEVIDYS 的(安全)更新
04/04/25 上午 8:44 美国东部夏令时间
马萨诸塞州剑桥——(BUSINESS WIRE)——2025 年 4 月 4 日——罕见疾病精准基因医学领域的领导者 Sarepta Therapeutics, Inc. (NASDAQ:SRPT) 分享了以下与 ELEVIDYS (delandistrogene moxeparvovec-rokl) 相关的最新消息,ELEVIDYS 是唯一获批用于治疗杜氏肌营养不良症患者的基因疗法。
继 3 月 18 日发布关于急性肝衰竭的安全更新后,欧盟 (EU) 参考成员国当局要求独立数据监测委员会 (DMC) 召开会议审查不良事件。在分析完成期间,ELEVIDYS 某些临床研究的招募和给药暂时停止。
独立 DMC 于 4 月 3 日召开会议,一致认为,根据全部证据,总体效益风险状况仍然有利于继续在暂停的临床试验中给药,而无需更改研究方案。应欧盟监管机构的要求,Sarepta 和罗氏将在一周内提交此信息以回应暂停。对提交信息的评估以及随后的解除暂停的决定将遵循欧盟监管程序。
受暂停影响的临床研究包括 SRP-9001-302 (ENVOL)、SRP-9001-303 (ENVISION) 和 SRP-9001-104 研究。已入组受试者的监测和数据收集仍在继续,我们预计这些研究的时间表不会受到重大影响。
股票市场上股票下跌。
https://dmdwarrior.com/dmd-warriors-turkish-representative-shares-his-views-on-elevidys-gene-therapy-is-it-effective-and-why-is-it-expensive/