Trois essais cliniques en cours sur ELEVIDYS (delandistrogene moxeparvovec-rokl), une thérapie génique développée par Sarepta et commercialisée par Roche, ont été temporairement interrompus par l'Agence européenne des médicaments (EMA). Cette nouvelle attendue, mais non déplaisante, a suscité une profonde tristesse au sein de la communauté des personnes atteintes de dystrophie musculaire de Duchenne (DMD).
Les essais suspendus comprennent l'étude de phase 3 Envision sponsorisée par Sarepta, qui évalue le Elevidys chez les garçons âgés de 8 à 17 ans ; l'étude de phase 2 Envol de Roche, qui étudie le Elevidys chez les bébés et les nouveau-nés ; et l'étude 104 de Sarepta, une étude de phase 1 sur le Elevidys chez les garçons âgés de 4 à 9 ans présentant des anticorps préexistants contre un sérotype particulier.
Avant Roche, Sarepta et EMA, la première communauté à publier cette annonce était notre partenaire turc >>> DMD Dayanisma.
Roche a publié une lettre à la communauté que vous pouvez lire ici.PDF)
Table des matières
Pourquoi les essais cliniques sur le Elevidys ont-ils été interrompus ?
Après le décès d'un garçon de 16 ans atteint de dystrophie musculaire de Duchenne qui a reçu une perfusion de Elevidys le 18 mars 2025, les perspectives de la thérapie génique, commercialisée au prix commercial de $3 millions, ont changé brusquement.En savoir plus)
En attendant que la cause précise du décès d'un adolescent américain ayant développé une insuffisance hépatique aiguë (IFA) après la prise de Elevidys soit établie, l'Agence européenne des médicaments (EMA) a demandé la suspension des études. Suite au décès du patient le mois dernier, Sarepta a annoncé qu'elle modifierait l'étiquette du Elevidys afin d'y inclure le signal de sécurité.
SRP-9001-104 temporairement interrompu
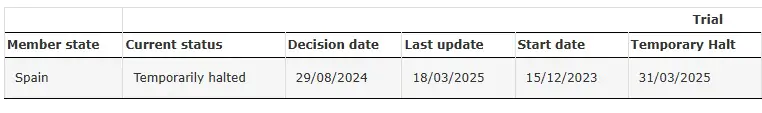
Source: Essai clinique du SRP-9001-104
ENVOL (Étude 302) temporairement interrompu
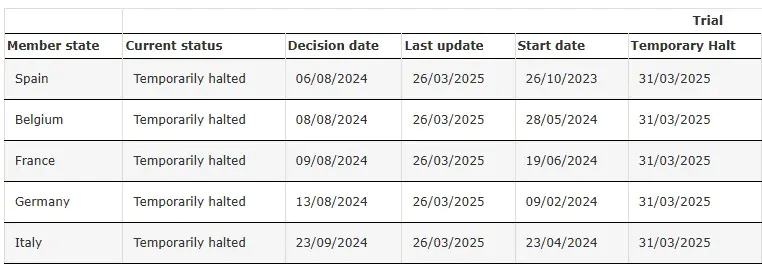
Source: Essai clinique du SRP-9001-302
SRP-9001-303 temporairement interrompu
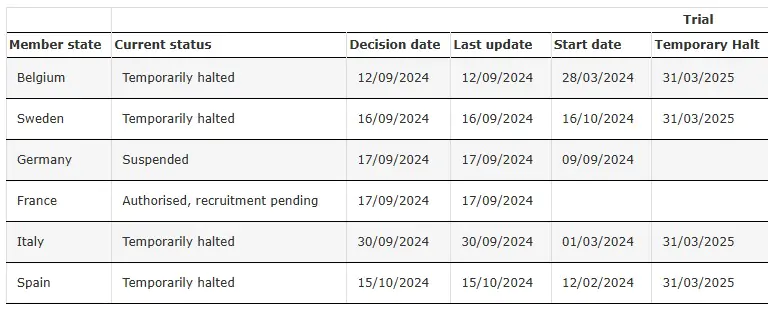
Source: Essai clinique du SRP-9001-303
Apprendre encore plus: Le représentant turc de DMD WarrioR partage son point de vue sur la thérapie génique Elevidys.




https://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-provides-update-elevidys
Sarepta Therapeutics fournit une mise à jour (de sécurité) sur ELEVIDYS
04/04/25 8:44 AM EDT
CAMBRIDGE, Massachusetts–(BUSINESS WIRE)–4 avril 2025– Sarepta Therapeutics, Inc. (NASDAQ : SRPT), leader de la médecine génétique de précision pour les maladies rares, a partagé la mise à jour suivante concernant ELEVIDYS (delandistrogene moxeparvovec-rokl), la seule thérapie génique approuvée chez les patients atteints de dystrophie musculaire de Duchenne.
Suite à la mise à jour de sécurité concernant l'insuffisance hépatique aiguë publiée le 18 mars, les autorités des pays membres de référence de l'Union européenne (UE) ont demandé au comité indépendant de surveillance des données (CID) de se réunir pour examiner l'événement indésirable. En attendant la finalisation de l'analyse, le recrutement et le dosage dans certaines études cliniques d'ELEVIDYS sont temporairement suspendus.
Le comité de gestion des données indépendant s'est réuni le 3 avril et a conclu que, sur la base de l'ensemble des données disponibles, le profil bénéfice-risque global reste favorable à la poursuite du traitement dans les essais cliniques suspendus sans modification des protocoles d'étude. À la demande des autorités réglementaires européennes, Sarepta et Roche soumettront ces informations en réponse à l'arrêt temporaire d'ici une semaine. L'évaluation de la demande et la décision ultérieure de levée de l'arrêt temporaire suivront la procédure réglementaire européenne.
Les études cliniques concernées par l'interruption temporaire sont les études SRP-9001-302 (ENVOL), SRP-9001-303 (ENVISION) et SRP-9001-104. Le suivi et la collecte de données pour les participants déjà inscrits se poursuivent, et nous ne prévoyons pas d'impact significatif sur le calendrier de ces études.
Les actions ont chuté en bourse.
https://dmdwarrior.com/dmd-warriors-turkish-representative-shares-his-views-on-elevidys-gene-therapy-is-it-effective-and-why-is-it-expensive/