Drei laufende klinische Studien zu ELEVIDYS (Delandistrogen Moxeparvovec-Rokl), einer von Sarepta entwickelten und von Roche vermarkteten Gentherapie, wurden von der Europäischen Arzneimittelagentur (EMA) vorübergehend gestoppt. Diese erwartete, aber nicht unwillkommene Nachricht löste in der Duchenne-Muskeldystrophie-Gemeinschaft (DMD) tiefe Trauer aus.
Zu den unterbrochenen Studien gehören die von Sarepta gesponserte Phase-3-Studie Envision, in der Elevidys bei Jungen im Alter von 8 bis 17 Jahren untersucht wird, die Phase-2-Studie Envol von Roche, in der Elevidys bei Babys und Neugeborenen untersucht wird, und die Studie 104 von Sarepta, eine Phase-1-Studie zu Elevidys bei Jungen im Alter von 4 bis 9 Jahren mit vorbestehenden Antikörpern gegen einen bestimmten Serotyp.
Vor Roche, Sarepta und EMA war unser türkischer Partner die erste Community, die diese Ankündigung veröffentlichte >>> DMD Dayanisma.
Roche hat einen Brief an die Community herausgegeben, den Sie hier lesen können. (PDF)
Inhaltsverzeichnis
Warum wurden die klinischen Studien zu Elevidys abgebrochen?
Nach dem Tod eines 16-jährigen Jungen mit Duchenne-Muskeldystrophie, der am 18. März 2025 eine Infusion mit Elevidys erhalten hatte, änderten sich die Aussichten für die Gentherapie, die zu einem kommerziellen Preis von $3 Millionen vermarktet wird, schlagartig. (Mehr lesen)
Bis die genaue Todesursache eines US-amerikanischen Teenagers, der nach der Einnahme von Elevidys ein akutes Leberversagen (ALF) entwickelte, geklärt ist, forderte die Europäische Arzneimittelagentur (EMA) die Aussetzung der Studien. Nach dem Tod des Patienten im vergangenen Monat kündigte Sarepta an, die Packungsbeilage von Elevidys um das Sicherheitssignal zu ergänzen.
SRP-9001-104 Vorübergehend angehalten
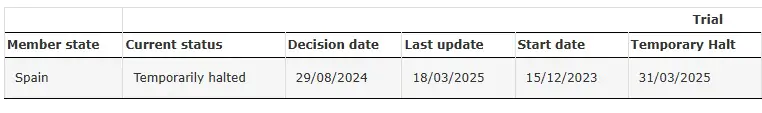
Quelle: Klinische Studie mit SRP-9001-104
ENVOL (Studie 302) vorübergehend ausgesetzt
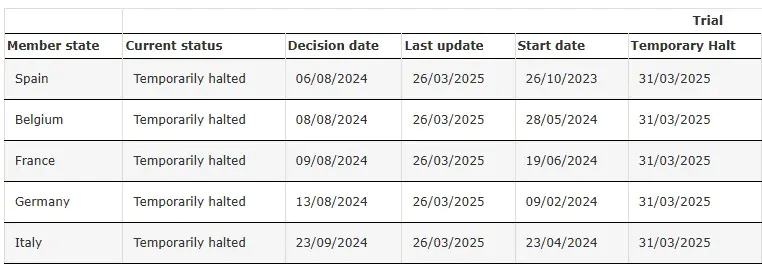
Quelle: Klinische Studie mit SRP-9001-302
SRP-9001-303 Vorübergehend angehalten
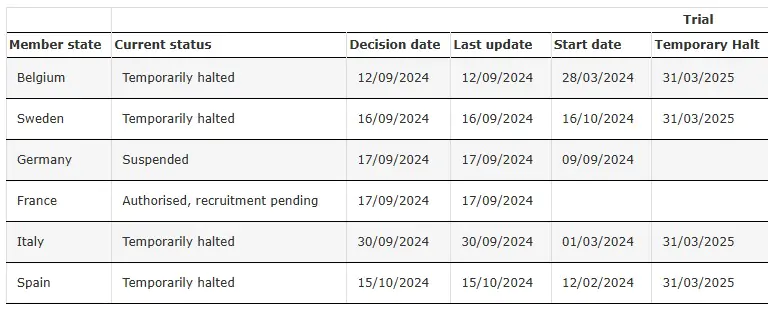
Quelle: Klinische Studie mit SRP-9001-303
Mehr erfahren: Der türkische Vertreter von DMD WarrioR teilt seine Ansichten zur Elevidys-Gentherapie.




https://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-provides-update-elevidys
Sarepta Therapeutics stellt (Sicherheits-)Update zu ELEVIDYS bereit
04/04/25 8:44 AM EDT
CAMBRIDGE, Mass.–(BUSINESS WIRE)–4. April 2025– Sarepta Therapeutics, Inc. (NASDAQ:SRPT), das führende Unternehmen im Bereich der Präzisionsgenetik für seltene Krankheiten, gab das folgende Update zu ELEVIDYS (Delandistrogen Moxeparvovec-Rokl) bekannt, der einzigen zugelassenen Gentherapie für Patienten mit Duchenne-Muskeldystrophie.
Nach dem Sicherheitsupdate zum akuten Leberversagen vom 18. März forderten die Behörden der Referenzmitgliedstaaten der Europäischen Union (EU) eine Sitzung des unabhängigen Datenüberwachungsausschusses (DMC) zur Überprüfung des unerwünschten Ereignisses. Während die Analyse abgeschlossen wird, sind die Rekrutierung und Dosierung für bestimmte klinische Studien zu ELEVIDYS vorübergehend ausgesetzt.
Das unabhängige DMC traf sich am 3. April und kam zu dem Schluss, dass das Nutzen-Risiko-Profil auf Grundlage der gesamten Evidenz weiterhin günstig für eine Fortsetzung der Dosierung in den pausierten klinischen Studien ohne Änderungen der Studienprotokolle ist. Auf Anfrage der EU-Regulierungsbehörden werden Sarepta und Roche diese Informationen innerhalb einer Woche als Reaktion auf die vorübergehende Aussetzung einreichen. Die Bewertung der Einreichung und die anschließende Entscheidung über die Aufhebung der vorübergehenden Aussetzung erfolgen im Rahmen des EU-Regulierungsverfahrens.
Von der vorübergehenden Unterbrechung betroffen sind die klinischen Studien SRP-9001-302 (ENVOL), SRP-9001-303 (ENVISION) und SRP-9001-104. Die Überwachung und Datenerhebung bereits eingeschriebener Teilnehmer wird fortgesetzt, und wir erwarten keine wesentlichen Auswirkungen auf den Zeitplan dieser Studien.
Die Kurse an der Börse fielen.
https://dmdwarrior.com/dmd-warriors-turkish-representative-shares-his-views-on-elevidys-gene-therapy-is-it-effective-and-why-is-it-expensive/