Elevidys — единственная одобренная в мире генная терапия для лечения мышечной дистрофии Дюшенна, получившая ускоренное одобрение в США в июне 2023 года, а теперь одобренная в Объединенных Арабских Эмиратах, Катаре, Кувейте, Бахрейне, Омане, Бразилии и Израиле для лечения ходячих детей в возрасте от 4 до 5 лет с болезнью Дюшенна, у которых подтверждена мутация в гене DMD. [Подробнее: Roche объявила, что EMA инициировала рассмотрение препарата ELEVIDYS]
Sarepta Therapeutics объявляет о расширении одобрения препарата FDA в США в 2024 году на препарат Elevidys для пациентов с мышечной дистрофией Дюшенна в возрасте от 4 лет и старше.
Оглавление

FDA расширенное одобрение генной терапии для пациентов с мышечной дистрофией Дюшенна
После этого заявления Управление по контролю за продуктами и лекарствами США расширило одобрение Elevidys (деландистроген моксепарвовек-рокл), генной терапии для лечения мышечной дистрофии Дюшенна (МДД) для амбулаторных и неамбулаторных лиц в возрасте от 4 лет и старше с МДД и подтвержденной мутацией в гене МДД. [Подробнее: Sarepta получила полное одобрение и расширение лейбла для DMD]
В каких странах одобрено Elevidys?
Генная терапия Elevidys теперь одобрена в США, Объединенных Арабских Эмиратах, Катаре, Кувейте, Бахрейне, Омане, Бразилии и Израиле.
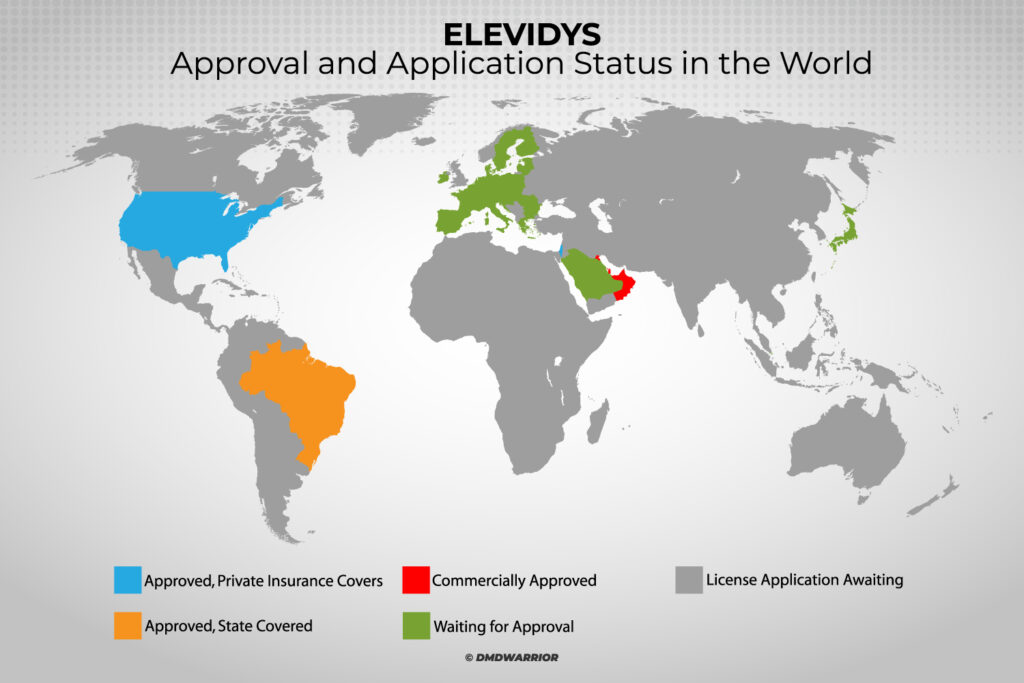
Не одобрит ли EMA Elevidys?
Европейское агентство по лекарственным средствам (EMA) запросило временную остановку исследований 104 (NCT06241950), 302 (ENVOL, NCT06128564) и 303 (ENVISION, NCT05881408) до завершения расследования в связи со смертью 16-летнего ребенка, который получил генную терапию Elevidys. (Подробнее: Исследования 104, 302 и 303 были временно приостановлены в Европе.)
Узнайте больше: Мышечная дистрофия Дюшенна: лечение и стоимость
Одобрен ли стандарт Elevidys в Европе?
Комитет Европейского агентства по лекарственным средствам постановил, что терапия под названием Elevidys не продемонстрировала в исследованиях улучшения двигательных способностей пациентов. Европейское агентство по лекарственным средствам рекомендовало отказать в выдаче регистрационного удостоверения Elevidys — лекарственного препарата, предназначенного для лечения мышечной дистрофии Дюшенна. - Читать далее: Европейское агентство по лекарственным средствам (EMA) вынесло отрицательное заключение по Elevidys –
В настоящее время заявки на одобрение рассматриваются в Швейцарии, Сингапуре, Гонконге и Саудовской Аравии. [Подробнее: Roche]
Узнать больше: Часто задаваемые вопросы об Elevidys, используемом при мышечной дистрофии Дюшенна



