Les thérapies géniques, notamment celles comme Elevidys, ont le potentiel de révolutionner le traitement des maladies génétiques rares et graves, comme la dystrophie musculaire de Duchenne (DMD). Développée par Sarepta, Elevidys est une thérapie génique conçue pour traiter cette maladie invalidante en remplaçant le gène défectueux responsable de la DMD par un gène fonctionnel. Malgré ses résultats prometteurs, Roche a choisi avec soin les marchés pour lesquels elle sollicite une autorisation réglementaire, ce qui soulève des questions quant aux raisons pour lesquelles elle ne sollicite pas d'autorisation de mise sur le marché dans tous les pays.
Si vous vous demandez quand la thérapie génique Elevidys arrivera dans votre pays, cet article peut vous aider à vous faire une idée.
Table des matières
Les complexités de l'expansion du marché mondial
La décision de Roche de ne pas demander d'autorisation de mise sur le marché dans tous les pays est motivée par une combinaison de facteurs commerciaux, réglementaires et stratégiques. L'un des principaux facteurs à prendre en compte est la complexité et les coûts liés à l'obtention d'une autorisation réglementaire dans différentes régions. Mais les entreprises Roche et Sarepta ne devraient pas se cacher derrière de telles excuses.
Les organismes de réglementation du monde entier, tels que la Food and Drug Administration (FDA) américaine (FDA) et l'Agence européenne des médicaments (EMA), appliquent des normes, des délais et des exigences variables aux produits de thérapie génique. Si les FDA et EMA ont considérablement accéléré le processus d'approbation des thérapies géniques, d'autres pays peuvent ne pas disposer de cadres similaires, ce qui rend le processus d'approbation plus lent, plus coûteux et plus incertain.
De plus, l'approbation réglementaire dans certaines régions peut nécessiter des essais cliniques approfondis ou des études locales qui ne sont pas toujours réalisables, notamment dans les pays où la prévalence de la maladie est plus faible ou où l'infrastructure clinique est insuffisante. Les ressources nécessaires à de tels essais peuvent être dissuasives pour une entreprise comme Roche, qui pourrait privilégier les marchés où elle perçoit le meilleur retour sur investissement.
Préoccupations commerciales : les enjeux importants des licences mondiales
Les considérations commerciales jouent également un rôle crucial dans les décisions de Roche. Le coût de la thérapie génique, en particulier celui du Elevidys, est extrêmement élevé ; une dose unique du traitement serait commercialisée à 152,3 millions de TP3.
Dans les pays où les systèmes de remboursement sont sous-développés ou où les budgets de santé sont limités, la viabilité financière de l’introduction d’une telle thérapie peut être discutable.
Même dans les pays dotés de systèmes de santé bien établis, comme en Europe ou aux États-Unis, la négociation des taux de remboursement peut être un processus long et incertain.
Dans de nombreux cas, les compagnies d’assurance et les gouvernements hésitent à approuver la couverture de thérapies dont le coût initial est aussi élevé, en particulier lorsque les bénéfices à long terme peuvent être difficiles à quantifier.
Roche prend également en compte la taille du marché dans chaque pays.
La dystrophie musculaire de Duchenne, bien que dévastatrice, touche une population de patients relativement restreinte dans une région donnée. Dans les pays où la DMD est moins répandue, le coût de la commercialisation du Elevidys pourrait ne pas justifier le retour sur investissement potentiel.
Roche pourrait préférer se concentrer sur des marchés plus vastes avec des populations de patients plus importantes ou des politiques de remboursement plus favorables, où le coût de mise sur le marché du médicament est plus facilement absorbé.
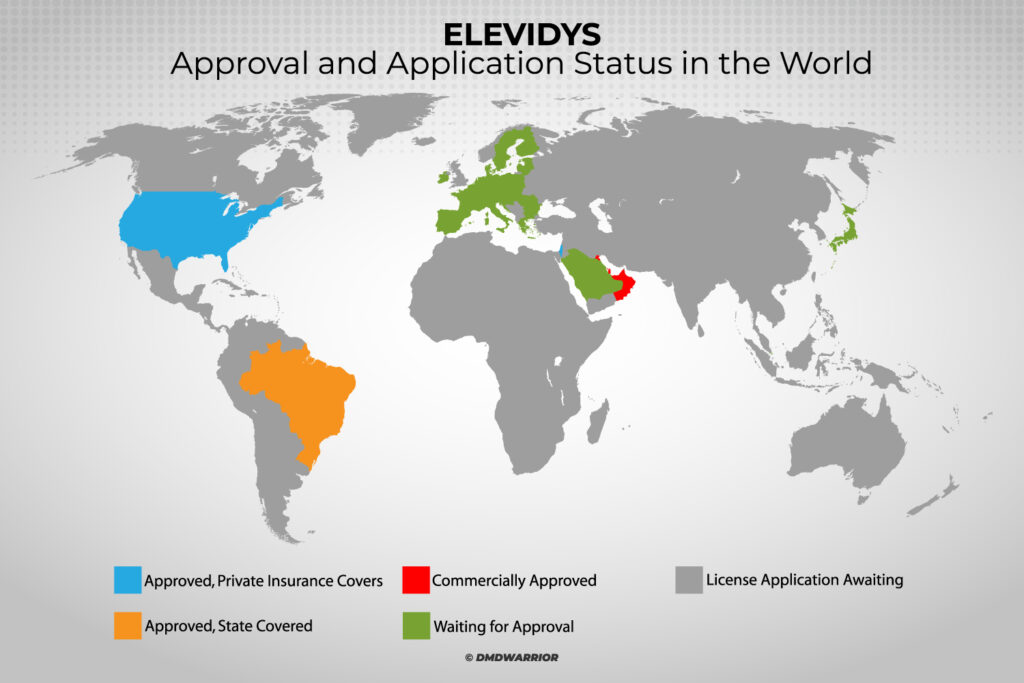
L'impact sur les familles qui cherchent un traitement à l'étranger
L’absence d’autorisation de mise sur le marché mondiale pour le Elevidys a des conséquences importantes pour les familles d’enfants souffrant de dystrophie musculaire de Duchenne, en particulier dans les pays où le traitement n’est pas disponible.
Les familles confrontées à des options thérapeutiques limitées n'ont souvent d'autre choix que de se faire soigner à l'étranger, où la thérapie pourrait être approuvée. Cette situation représente un fardeau financier considérable pour les patients et leurs familles.
Le coût élevé du Elevidys, associé aux frais supplémentaires liés aux voyages à l'étranger (déplacements médicaux, hébergement et autres frais logistiques), peut être prohibitif. Pour de nombreuses familles, le choix de se faire soigner à l'étranger peut entraîner des difficultés financières, voire la faillite.
De plus, le coût émotionnel et physique des déplacements pour recevoir un traitement vital peut aggraver la situation déjà difficile à laquelle sont confrontés les patients et leurs familles.
Bien que certains gouvernements et organisations à but non lucratif s’efforcent de subventionner le coût des déplacements médicaux, ces efforts sont souvent insuffisants pour couvrir l’ensemble des dépenses impliquées.
Les familles peuvent également être confrontées à l’incertitude et au stress liés à la navigation dans les systèmes de santé étrangers, qui peuvent varier considérablement de leur pays d’origine.
En outre, le manque d’options de traitement locales peut créer un sentiment d’inégalité, car seuls ceux qui sont financièrement en mesure de se faire soigner à l’étranger auront accès à des thérapies potentiellement vitales comme le Elevidys.
Quelle est l’efficacité du Elevidys ?
Sarepta a déjà déclaré que sa thérapie génique Elevidys n’est pas un remède définitif.
Lorsque des études cliniques sont examinées, on peut constater qu'il ne produit pas de niveaux très élevés de dystrophine et que ses scores d'évaluation ambulatoire North Star (NSAA) ne sont pas aussi impressionnants que prévu. [En savoir plus]
Le prix du Elevidys est-il raisonnable compte tenu des résultats des essais cliniques ?
À notre avis, non.
Alors pourquoi la thérapie génique Elevidys est-elle si chère ? [En savoir plus]
De nombreux patients atteints de DMD et leurs familles pensent que la raison pour laquelle le Elevidys est si cher est que les entreprises veulent faire du profit.
C’est pourquoi les patients et les familles qui ont encore du temps attendent avec impatience que des thérapies géniques alternatives soient approuvées et mises sur le marché.Nouvelles thérapies géniques]
La politique de prix élevés de Sarepta et Roche sape la confiance dans ces entreprises et dans la thérapie génique.
Des revenus élevés grâce aux campagnes individuelles
Roche et Sarepta poussent-ils les patients atteints de DMD à faire campagne individuellement ?
De nombreuses familles, dont le pays n’a pas encore approuvé la thérapie génique Elevidys, tentent de collecter des fonds en organisant des campagnes individuelles.
Un commerce similaire à celui pratiqué au Brésil pourrait ne pas être très rentable. Serait-ce la raison ? [Modèle de partage des risques avec Roche]
Qu'est-ce que tu penses de ça ?
En tant que DMDWarrioR, nous avons envoyé des courriels à Sarepta et à Roche sur ce problème à plusieurs reprises.
Nous avons demandé pourquoi ils ne demandent pas d’autorisation de mise sur le marché dans tous les pays !
Mais ils ne nous ont pas donné de réponse définitive et convaincante.
Cela nous a laissé des sentiments négatifs sur le prix exorbitant du Elevidys et pourquoi aucune demande n'a été faite.
Conclusion : La nécessité d'un accès plus large à la thérapie génique
L'approche sélective de Roche pour les demandes d'autorisation de mise sur le marché du Elevidys dans différents pays reflète la complexité du marché pharmaceutique mondial. Les obstacles réglementaires, les coûts élevés et les préoccupations commerciales pèsent lourdement sur le processus décisionnel de l'entreprise. Cependant, les conséquences pour les familles en quête de traitement sont importantes, nombre d'entre elles devant supporter le fardeau financier et émotionnel d'une recherche de soins à l'étranger.
Pour améliorer l’accès à des thérapies qui changent la vie comme Elevidys, il est essentiel que les sociétés pharmaceutiques et les gouvernements collaborent pour réduire les obstacles à l’approbation et élargir l’accès aux thérapies géniques.En savoir plus]
Les efforts visant à normaliser les exigences réglementaires, à augmenter les options de remboursement et à soutenir l’aide financière aux familles pourraient contribuer à garantir que tous les patients, quel que soit leur lieu de résidence, aient la possibilité de bénéficier de traitements révolutionnaires comme le Elevidys.
À long terme, un meilleur accès mondial aux thérapies géniques pourrait ouvrir la voie à des systèmes de santé plus équitables et garantir que les traitements vitaux ne soient pas limités par la géographie ou les moyens financiers.



