Elevidys est la seule thérapie génique approuvée au monde pour la dystrophie musculaire de Duchenne et a reçu une approbation accélérée aux États-Unis en juin 2023, et est désormais approuvée aux Émirats arabes unis, au Qatar, au Koweït, à Bahreïn, à Oman, au Brésil et en Israël pour le traitement des enfants ambulatoires âgés de 4 à 5 ans atteints de la maladie de Duchenne, qui présentent une mutation confirmée du gène DMD. [Lire la suite : Roche a annoncé que EMA a lancé l'examen du test ELEVIDYS]
Sarepta Therapeutics annonce l'extension de l'approbation américaine du FDA en 2024 pour le Elevidys pour les patients atteints de dystrophie musculaire de Duchenne âgés de 4 ans et plus.
Table des matières

FDA Approbation élargie de la thérapie génique pour les patients atteints de dystrophie musculaire de Duchenne
Après cette annonce, la Food and Drug Administration américaine a étendu l'approbation du Elevidys (delandistrogene moxeparvovec-rokl), une thérapie génique pour le traitement de la dystrophie musculaire de Duchenne (DMD) chez les personnes ambulatoires et non ambulatoires âgées de 4 ans et plus atteintes de DMD avec une mutation confirmée du gène DMD. [Lire la suite : Sarepta obtient l'approbation complète et l'extension de l'étiquette pour DMD]
Dans quels pays le Elevidys est-il approuvé ?
La thérapie génique Elevidys est désormais approuvée aux États-Unis, aux Émirats arabes unis, au Qatar, au Koweït, à Bahreïn, à Oman, au Brésil et en Israël.
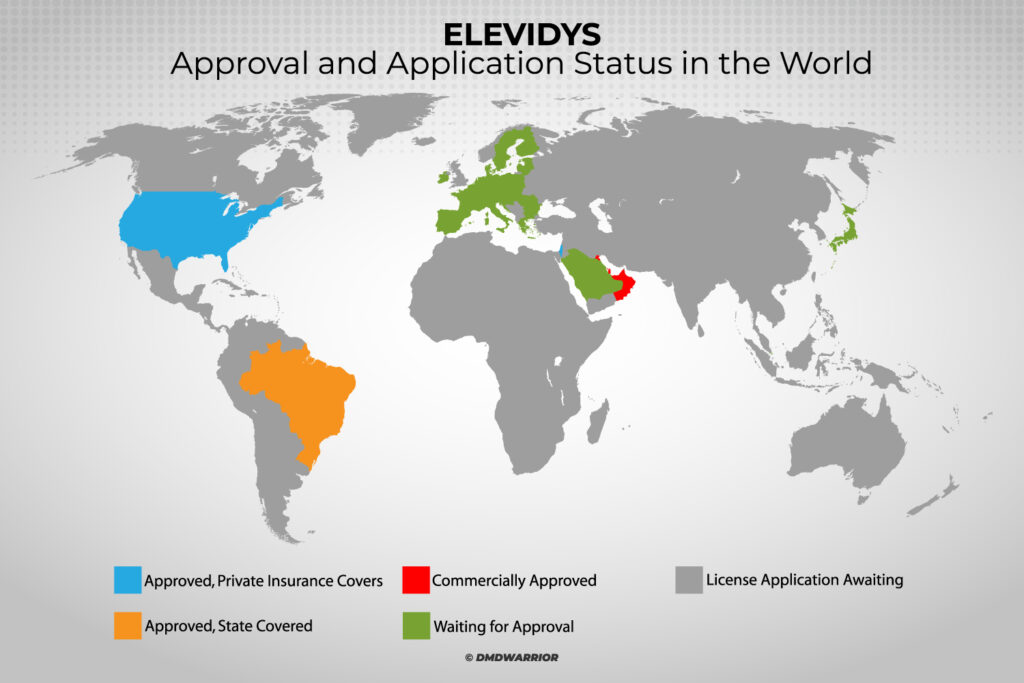
Le EMA n'approuvera-t-il pas le Elevidys ?
L'Agence européenne des médicaments (EMA) a demandé l'arrêt temporaire des études 104 (NCT06241950), 302 (ENVOL, NCT06128564) et 303 (ENVISION, NCT05881408) en attendant la fin de leur enquête, en raison du décès d'un enfant de 16 ans ayant reçu une thérapie génique Elevidys. (Lire la suite : Les études 104, 302 et 303 ont été temporairement interrompues en Europe)
En savoir plus : Dystrophie musculaire de Duchenne : traitement et coût
Le Elevidys est-il approuvé en Europe ?
Le comité de l'Agence européenne des médicaments a estimé que la thérapie, appelée Elevidys, n'avait pas démontré dans les études qu'elle améliorait les capacités de mouvement des patients. L'Agence européenne des médicaments a recommandé le refus de l'autorisation de mise sur le marché du Elevidys, un médicament destiné au traitement de la dystrophie musculaire de Duchenne. - En savoir plus: L'Agence européenne des médicaments (EMA) a émis un avis négatif sur Elevidys –
Les demandes d'approbation sont actuellement à l'étude en Suisse, à Singapour, à Hong Kong et en Arabie saoudite. [Lire la suite : Roche]
Apprendre encore plus: Questions fréquemment posées sur Elevidys utilisé pour la dystrophie musculaire de Duchenne



