Sarepta tarafından geliştirilen ve Roche tarafından pazarlanan bir gen terapisi olan ELEVIDYS'in (delandistrogene moxeparvovec-rokl) devam eden üç klinik denemesi, Avrupa İlaç Ajansı (EMA) tarafından geçici olarak durduruldu. Beklenen ancak istenmeyen bu haber, Duchenne kas distrofisi (DMD) topluluğunda derin bir üzüntüye neden oldu.
Duraklatılan çalışmalar arasında, 8 ila 17 yaş arasındaki erkek çocuklarında Elevidys'yi değerlendiren Sarepta destekli faz 3 Envision çalışması; bebeklerde ve yenidoğanlarda Elevidys'yi araştıran Roche'un faz 2 Envol çalışması; ve Sarepta'nın Çalışma 104'ü, belirli bir serotipe karşı önceden var olan antikorları olan 4 ila 9 yaş arasındaki erkek çocuklarında Elevidys'ye yönelik faz 1 araştırması yer alıyor.
Roche, Sarepta ve EMA'den önce bu duyuruyu yayınlayan ilk topluluk Türk ortağımızdı >>> DMD Dayanışma.
Roche, topluma bir mektup gönderdi, mektubu burada okuyabilirsiniz.PDF)
İçindekiler
Elevidys Klinik Araştırmaları Neden Durduruldu?
18 Mart 2025'te Elevidys infüzyonu alan Duchenne kas distrofisi hastası 16 yaşındaki bir erkek çocuğunun ölümünden sonra, $3 milyon dolarlık ticari fiyatla pazarlanan gen terapisinin görünümü aniden değişti.Devamını oku)
Elevidys aldıktan sonra akut karaciğer yetmezliği (ALF) geliştiren bir ABD gencinin kesin ölüm nedeni belirlenene kadar, Avrupa İlaç Ajansı (EMA) çalışmaların askıya alınmasını talep etti. Hasta geçen ay vefat ettiğinde, Sarepta Elevidys'nin etiketini güvenlik sinyalini içerecek şekilde değiştireceğini duyurdu.
SRP-9001-104 Geçici Olarak Durduruldu
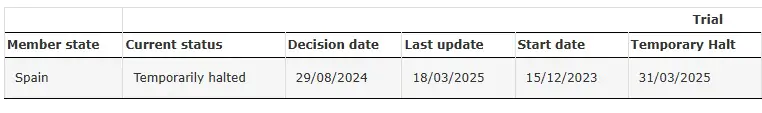
Kaynak: SRP-9001-104'ün Klinik Denemesi
ENVOL (Çalışma 302) Geçici Olarak Durduruldu
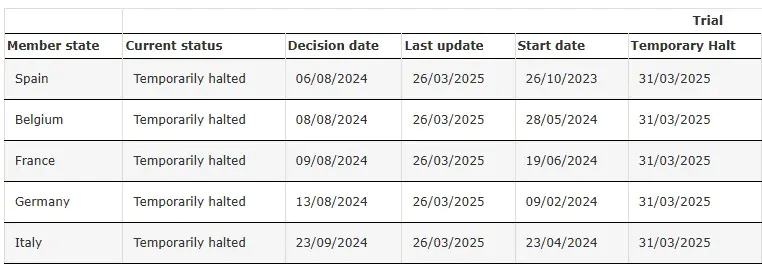
Kaynak: SRP-9001-302'nin Klinik Denemesi
SRP-9001-303 Geçici Olarak Durduruldu
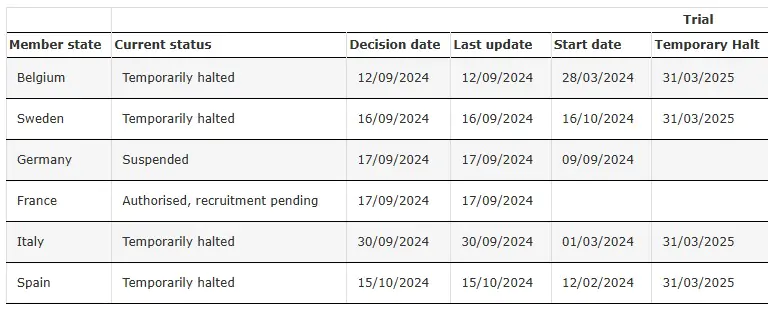
Kaynak: SRP-9001-303'ün Klinik Denemesi
Daha fazla bilgi edin: DMD WarrioR'un Türkiye Temsilcisi Elevidys Gen Terapisi Hakkındaki Görüşlerini Paylaşıyor.




https://investorrelations.sarepta.com/news-releases/news-release-details/sarepta-therapeutics-provides-update-elevidys
Sarepta Therapeutics, ELEVIDYS'e (güvenlik) ilişkin güncelleme sağlıyor
04/04/25 08:44 AM EDT
CAMBRIDGE, Mass.–(BUSINESS WIRE)–4 Nisan 2025– Nadir hastalıklar için hassas genetik tıp alanında lider olan Sarepta Therapeutics, Inc. (NASDAQ:SRPT), Duchenne kas distrofisi hastalarında onaylı tek gen tedavisi olan ELEVIDYS (delandistrogene moxeparvovec-rokl) ile ilgili aşağıdaki güncellemeyi paylaştı.
18 Mart'ta yayınlanan akut karaciğer yetmezliğine ilişkin güvenlik güncellemesinin ardından, Avrupa Birliği (AB) referans üye ülke yetkilileri, olumsuz olayı incelemek üzere bağımsız veri izleme komitesinin (DMC) toplanmasını talep etti. Analiz tamamlanırken, ELEVIDYS'in belirli klinik çalışmalarında katılımcı alımı ve dozlama geçici olarak durduruldu.
Bağımsız DMC 3 Nisan'da toplandı ve kanıtların tamamına dayanarak, genel fayda-risk profilinin, çalışma protokollerinde değişiklik yapılmadan duraklatılan klinik çalışmalarda dozajlamaya devam etmek için olumlu olmaya devam ettiği konusunda mutabık kaldı. AB düzenleyicilerinin talebi üzerine, Sarepta ve Roche bu bilgileri bir hafta içinde geçici durdurmaya yanıt olarak sunacak. Sunumun değerlendirilmesi ve geçici durdurmanın kaldırılmasına ilişkin sonraki karar AB düzenleyici sürecini takip edecektir.
Geçici durdurmadan etkilenen klinik çalışmalar Çalışma SRP-9001-302 (ENVOL), Çalışma SRP-9001-303 (ENVISION) ve Çalışma SRP-9001-104'tür. Zaten kayıtlı katılımcılar için izleme ve veri toplama devam etmektedir ve bu çalışmaların zaman çizelgesi üzerinde önemli bir etki öngörmüyoruz.
Borsada hisse senetleri düştü.
https://dmdwarrior.com/dmd-warriors-turkish-representative-shares-his-views-on-elevidys-gene-therapy-is-it-effective-and-why-is-it-expensive/