Elevidys é a única terapia genética aprovada no mundo para distrofia muscular de Duchenne e recebeu aprovação acelerada nos EUA em junho de 2023, e agora está aprovada nos Emirados Árabes Unidos, Catar, Kuwait, Bahrein, Omã, Brasil e Israel para o tratamento de crianças ambulantes de 4 a 5 anos com Duchenne, que têm uma mutação confirmada no gene DMD. [Leia mais: A Roche anunciou que a EMA iniciou a revisão do ELEVIDYS]
A Sarepta Therapeutics anuncia a expansão da aprovação do FDA nos EUA em 2024 para o Elevidys para pacientes com distrofia muscular de Duchenne com 4 anos ou mais.
Índice

FDA Aprovação expandida de terapia genética para pacientes com distrofia muscular de Duchenne
Após este anúncio, a Food and Drug Administration dos EUA expandiu a aprovação do Elevidys (delandistrogene moxeparvovec-rokl), uma terapia genética para o tratamento da distrofia muscular de Duchenne (DMD) para indivíduos ambulatoriais e não ambulatoriais com 4 anos de idade ou mais com DMD e uma mutação confirmada no gene DMD. [Leia mais: Sarepta ganha aprovação total e expansão de rótulo para DMD]
Em quais países o Elevidys é aprovado?
A terapia genética Elevidys agora é aprovada nos EUA, Emirados Árabes Unidos, Catar, Kuwait, Bahrein, Omã, Brasil e Israel.
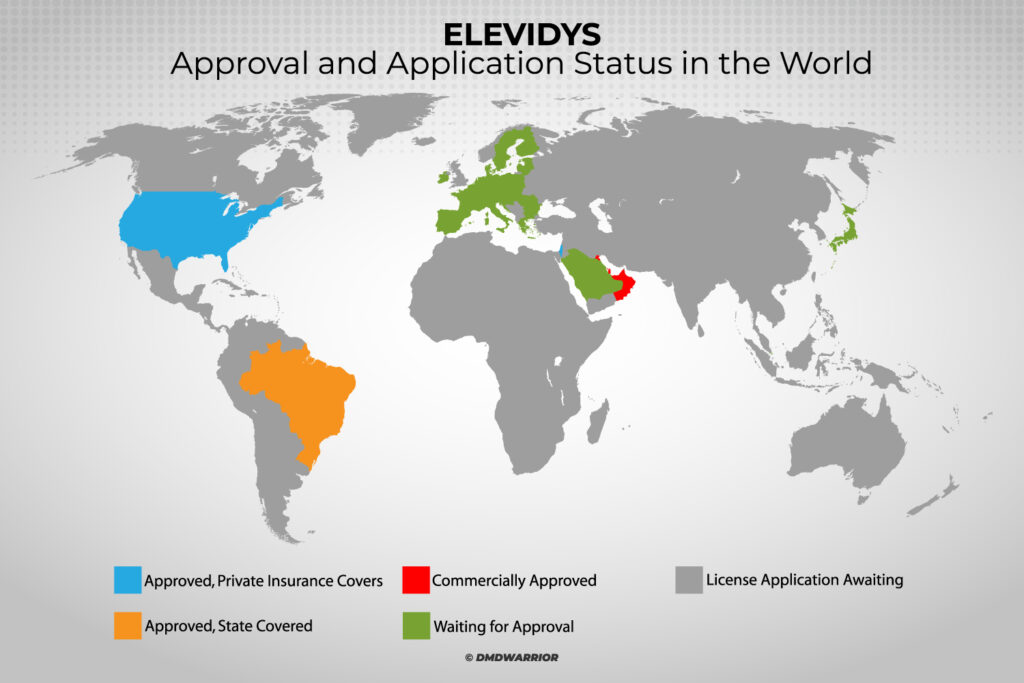
O Elevidys é aprovado na Europa?
A Roche anuncia que o EMA iniciou a análise do pedido de Autorização de Comercialização do Elevidys para o tratamento da distrofia muscular de Duchenne (DMD).
A investigação do EMA está sendo acompanhada na Europa e na Turquia. Pacientes com distrofia muscular de Duchenne e suas famílias estão acompanhando os desenvolvimentos de perto e aguardando ansiosamente o dia em que receberão o medicamento.
Os pedidos de aprovação estão atualmente sob análise na Europa (EMA), Japão, Suíça, Cingapura, Hong Kong e Arábia Saudita. [Leia mais: Roche]
Saber mais: Perguntas frequentes sobre Elevidys usado para distrofia muscular de Duchenne
O EMA não aprovará o Elevidys?
A Agência Europeia de Medicamentos (EMA) solicitou uma interrupção temporária dos Estudos 104 (NCT06241950), Estudo 302 (ENVOL, NCT06128564) e Estudo 303 (ENVISION, NCT05881408) enquanto aguardam a conclusão de sua investigação devido à morte de uma criança de 16 anos que recebeu terapia genética Elevidys. (Leia mais: O Estudo 104, o Estudo 302 e o Estudo 303 foram temporariamente interrompidos na Europa)
Este anúncio, que incomodou as famílias europeias que aguardavam a aprovação do Elevidys, trouxe à mente a ideia de que a terapia genética não será aprovada na região EMA a menos que evidências suficientes sejam fornecidas.
Descubra mais: Distrofia Muscular de Duchenne: Tratamento e Custo


