Процесс разработки лекарств — это очень сложный, длительный и дорогостоящий путь, который охватывает многие годы, обычно от 10 до 15 лет, от первоначального открытия до запуска на рынок. Включая лекарства от мышечной дистрофии ДюшеннаОн включает в себя несколько этапов, каждый из которых тщательно разработан для оценки безопасности, эффективности и потенциальных рисков нового препарата, прежде чем он может быть представлен широкой публике. Этапы разработки лекарств делятся на доклинические исследования и клинические испытания, которые являются основным направлением деятельности регулирующих органов, таких как Управление по контролю за продуктами и лекарствами (FDA) и Европейское агентство по лекарственным средствам (EMA).
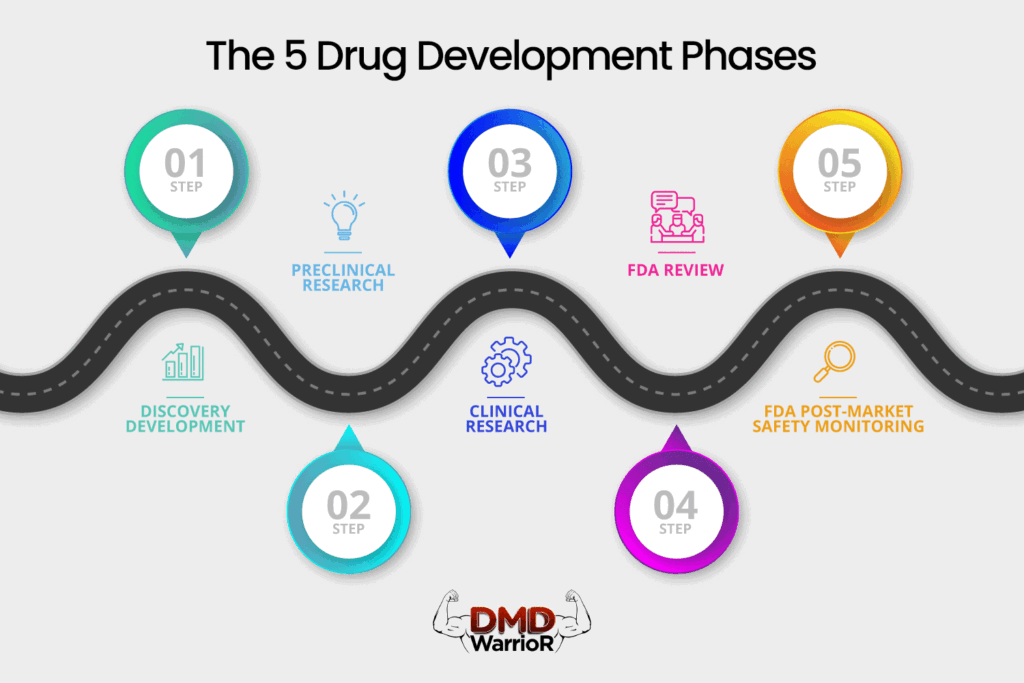
Новый препарат должен пройти пять отдельных этапов, чтобы считаться «успешным»: 1) открытие и разработка; 2) доклинические исследования; 3) клинические испытания; 4) рассмотрение препарата FDA; и 5) мониторинг безопасности после выхода на рынок FDA. [FDA]
Оглавление
Открытие и развитие
Прежде чем лекарство попадет в фазу клинических испытаний, проводится значительное количество предварительных исследований. Эта фаза включает:
- Открытие лекарств: Начальный шаг включает в себя идентификацию биологической цели (например, белка или гена), которая участвует в заболевании. Ученые могут просматривать большие библиотеки соединений, чтобы определить кандидатов, которые могут повлиять на цель. Затем эти соединения оптимизируются для повышения их эффективности и снижения потенциальных побочных эффектов.
Доклинические исследования
- Доклинические исследования: После того, как перспективное соединение идентифицировано, оно проходит лабораторные испытания in vitro (вне живого организма) и in vivo (в живых организмах, как правило, животных) для оценки его токсичности, фармакокинетики (как препарат всасывается, распределяется, метаболизируется и выводится из организма) и фармакодинамики (как препарат влияет на организм). Эти исследования помогают определить, будет ли препарат безопасным и эффективным для людей.
- Токсикологические исследования: В ходе доклинических исследований ученые проводят детальные исследования для оценки любых потенциальных вредных эффектов препарата. Цель состоит в том, чтобы определить максимально переносимую дозу и любые побочные эффекты, которые могут возникнуть.
Если доклинические исследования проходят успешно, препарат переходит на стадию клинических испытаний, которая включает тестирование препарата на людях.
Клинические испытания
Что такое клинические испытания фазы 1, фазы 2 и фазы 3?
Процесс клинических испытаний делится на четыре отдельные фазы (Фаза 1, Фаза 2, Фаза 3 и Фаза 4) для постепенной оценки безопасности, эффективности и общего соотношения пользы и риска препарата у людей. Каждая фаза служит уникальной цели в процессе оценки.
Фаза 1: Безопасность и дозировка
Фаза 1 — это первый раз, когда препарат испытывается на людях после доклинических исследований. Основная цель испытаний фазы 1 — оценить профиль безопасности препарата, определить безопасный диапазон дозировок и выявить любые побочные эффекты.
- Дизайн исследования: Обычно испытания фазы 1 небольшие, в них участвуют от 20 до 100 здоровых добровольцев или людей с заболеванием/состоянием. Эти испытания обычно проводятся в контролируемой клинической среде, например в больнице или исследовательском центре.
- Цели:
- Безопасность: Исследователи внимательно следят за добровольцами на предмет возникновения любых побочных эффектов: от легких симптомов до более серьезных реакций.
- Дозировка: Начальная дозировка препарата часто консервативна. Препарат постепенно увеличивается в процессе, известном как эскалация дозы, чтобы определить максимально переносимую дозу.
- Фармакокинетика и фармакодинамика: Исследователи также изучают, как препарат всасывается, распределяется, метаболизируется и выводится из организма, а также его биологические эффекты.
- Продолжительность: Испытания фазы 1 обычно длятся несколько месяцев. В случае успеха препарат переходит в фазу 2.
Фаза 2: Эффективность и побочные эффекты
Испытания фазы 2 проводятся для дальнейшего изучения эффективности и безопасности препарата среди определенной группы пациентов, страдающих заболеванием или состоянием, для лечения которого предназначен препарат.
- Дизайн исследования: Эти испытания обычно масштабнее, чем Фаза 1, в них участвуют от 100 до 300 человек. Основное внимание уделяется проверке эффективности препарата у пациентов и выявлению любых побочных эффектов, связанных с длительным использованием.
- Цели:
- Эффективность: Исследователи стремятся определить, производит ли препарат желаемый терапевтический эффект у пациентов с целевым состоянием. Эффективность измеряется по клиническим результатам, таким как улучшение симптомов или биомаркеров заболевания.
- Безопасность: Как и в Фазе 1, исследователи продолжают следить за безопасностью, но основной целью является выявление любых побочных эффектов, которые могут возникнуть у пациентов с этим заболеванием.
- Оптимальная доза: В ходе Фазы 2 исследователи дополнительно совершенствуют режим дозирования препарата на основе информации, полученной в Фазе 1.
- Продолжительность: Испытания фазы 2 обычно длятся от нескольких месяцев до нескольких лет. Если препарат показывает эффективность и благоприятный профиль безопасности, он переходит в фазу 3.
Фаза 3: Подтверждающие испытания (эффективность и безопасность)
Испытания фазы 3 — это масштабные исследования, призванные подтвердить эффективность препарата, отслеживать его побочные эффекты и сравнивать его с существующими методами лечения или плацебо. Эта фаза играет решающую роль в определении того, следует ли одобрять препарат для использования регулирующими органами.
- Дизайн исследования: Испытания фазы 3 включают гораздо большее количество участников, обычно от 1000 до 3000 и более. Эти испытания часто являются многоцентровыми, то есть проводятся в нескольких местах, а иногда даже на международном уровне.
- Цели:
- Эффективность: Цель — подтвердить, что препарат обеспечивает клинически значимую пользу по сравнению с существующими методами лечения или плацебо.
- Безопасность: Исследователи продолжают отслеживать побочные эффекты, но больший размер выборки помогает выявлять менее распространенные нежелательные явления, которые могли быть пропущены на более ранних этапах.
- Сравнительная эффективность: В ходе испытаний фазы 3 новый препарат часто сравнивают со стандартными методами лечения или плацебо, чтобы продемонстрировать его превосходство или не меньшую эффективность.
- Продолжительность: Испытания фазы 3 могут длиться несколько лет из-за необходимости обширного сбора данных. Эти испытания часто являются самой дорогой и трудоемкой частью процесса разработки лекарств.
- Конечный результат: Если испытание фазы 3 прошло успешно, спонсор препарата может подать заявку на новый препарат (NDA) или заявку на получение лицензии на биологические препараты (BLA) в регулирующие органы, такие как FDA или EMA. В случае одобрения препарат переходит в финальную фазу: Фаза 4.
Обзор препарата FDA
Результаты клинических испытаний безопасности и эффективности лекарственного препарата проверяются группой специалистов, в которую входят врачи, химики, статистики, микробиологи и фармакологи, после того как препарат прошел фазы 1, 2, 3 и 4 клинических испытаний.
Биотехнологическая или фармацевтическая компания должна подать заявку на лицензию Biologics License Application (BLA) для биологических препаратов или заявку на новый препарат (NDA) для лекарств, чтобы запросить оценку FDA. После этого FDA должен одобрить заявку и назначить группу специалистов для оценки ее достоинств.
Группа изучает клиническое исследование совместно, принимая во внимание анализ риска и пользы лекарства, возможные побочные эффекты и результаты для пациентов. FDA разрешает производство, маркетинг и распространение препарата в США, если он считается безопасным и эффективным для предполагаемого использования.
FDA Мониторинг безопасности после продажи
После одобрения препарата регулирующими органами он переходит в пострегистрационную фазу, также известную как Фаза 4. На этой фазе препарат доступен для использования населением в целом, но исследователи продолжают следить за его долгосрочной безопасностью, эффективностью и любыми редкими или долгосрочными побочными эффектами.
- Постмаркетинговый надзор: На 4-й фазе текущие исследования и отчеты пациентов (например, из систем отчетности о нежелательных явлениях) помогают выявить любые редкие побочные эффекты, которые могли не быть обнаружены в ходе более ранних испытаний.
- Реальные данные: Исследователи также собирают данные о том, как препарат действует в реальных условиях и среди различных групп населения, которые могли быть недостаточно представлены в клинических испытаниях.
Узнать больше: Лечения Дюшенна (список всех исследований)
Заключение: важность каждой фазы в разработке лекарственных препаратов
Каждая фаза клинической разработки препарата играет решающую роль в обеспечении безопасности и эффективности нового препарата до его выхода на рынок. От фазы 1, где безопасность является первостепенной задачей, до фазы 3, где тщательно тестируется общее соотношение пользы и риска препарата на большой популяции пациентов, и фазы 4, где отслеживаются долгосрочные эффекты после выхода на рынок, каждая фаза вносит вклад в понимание того, как препарат повлияет на пациентов.
Весь процесс разработки лекарств — это сложный процесс балансирования, поскольку фармацевтические компании, регулирующие органы и исследователи работают вместе, чтобы вывести на рынок инновационные и меняющие жизнь методы лечения, минимизируя при этом потенциальный вред. Время, усилия и затраты, вложенные в разработку лекарств, существенны, но они необходимы для развития медицинской науки и улучшения результатов лечения пациентов по всему миру.



