Насколько эффективна генная терапия ELEVIDYS (delandistrogene moxeparvovec-rokl), которая была представлена на фармацевтическом рынке, по отношению к ее стоимости в 3 миллиона американских долларов? Обзор клинических испытаний генной терапии Elevidys станет основной темой этого эссе. Мы оценим стоимость и эффективность этой генной терапии, которая была разработана для лечения мышечной дистрофии Дюшенна. Оправдывает ли стоимость Elevidys по сравнению с клиническими испытаниями?
Оглавление
Обзор клинических испытаний
Управление по контролю за продуктами и лекарствами (FDA) одобрило в 2023 и 2024 годах революционную генную терапию для редкого, но смертельного заболевания детского возраста — мышечной дистрофии Дюшенна.
На разрешение 2023 года имели право только дети в возрасте 4–5 лет, которые могли ходить (амбулаторно).
Постановление 2024 года расширило это разрешение, включив в него традиционное одобрение для амбулаторных пациентов с этим заболеванием и подтвержденной мутацией в гене МДД в возрасте 4 лет и старше.
Кроме того, постановление FDA устанавливает ускоренную процедуру одобрения для лиц в возрасте 4 лет и старше, передвигающихся на инвалидных колясках.
Ни одно из одобрений не было подкреплено соответствующими результатами клинических испытаний, показывающими, что у детей с МДД сохранилась или восстановилась крупная моторика, а также положительными научными оценками FDA.
Директор FDA проигнорировал мнение научного персонала агентства, что привело к получению обоих одобрений.
В этой статье обсуждаются два плохо продуманных утверждения, а также причины, по которым лидеры FDA не должны следовать их примеру в будущем. В ней также предлагаются предложения о том, как FDA может изменить способ рассмотрения спорных нормативных решений.
Как Elevidys получил одобрение FDA
Два рандомизированных клинических испытания фазы 3 деландистрогена моксепарвовека-рокла (Elevidys) в качестве генного заместительного лечения мышечной дистрофии Дюшенна (МДД) были опубликованы в журнале Nature Medicine 29 октября 2024 г. [1] Согласно отчету, клиническая эффективность этого препарата не была окончательно доказана по двум причинам.
Оба испытания не достигли своих первичных конечных точек для клинической пользы. Клиническая польза оценивалась с использованием стандартизированной шкалы, которая измеряет траекторию общей двигательной активности, включая стояние, ходьбу, прыжки и подъемы головы.
Во-вторых, альтернативные конечные точки, которые были в некоторой степени благоприятными и в конечном итоге использовались Управлением по контролю за продуктами питания и лекарственными средствами (FDA) для поддержки одобрения, не могли быть проверены с помощью статистического тестирования.
Кроме того, основным альтернативным результатом были уровни белка микродистрофина, биомаркера, который недавно не показал клинической значимости в другом исследовании генной терапии МДД. [2]
Когда был одобрен Elevidys?
Несмотря на ограниченные клинические данные, 22 июня 2023 года деландистроген моксепарвовек-рокл получил одобрение FDA в качестве первого препарата для заместительной генной терапии при мышечной дистрофии Дюшенна (МДД), в частности, для детей в возрасте от 4 до 5 лет, способных передвигаться самостоятельно. [3]
Одобрение было получено в рамках программы ускоренного одобрения FDA. [4]
20 июня 2024 года FDA расширил свое одобрение, включив в него традиционное разрешение для амбулаторных лиц в возрасте 4 лет и старше, у которых диагностировано заболевание и имеется подтвержденная мутация в гене DMD. Агентство также предоставило ускоренное одобрение для лиц в возрасте 4 лет и старше, которые зависят от инвалидных колясок. [5]
В документе клинического обзора FDA, касающемся расширенного действия по одобрению, было отмечено тревожное заявление: [6]
Доктор Питер Маркс, директор Центра оценки и исследований биологических препаратов (CBER), одобрил заявку, отклонив рекомендацию группы экспертов.
Деландистроген моксепарвовек-рокл теперь одобрен для продажи в Соединенных Штатах. Недавно стоимость терапии составила более $3 миллионов за курс лечения. [7]
Мышечная дистрофия Дюшенна (МДД) — редкое, прогрессирующее и фатальное заболевание, характеризующееся отсутствием эффективных альтернатив лечения.
Мутации мышечной дистрофии Дюшенна (DMD) в основном рецессивные и сцепленные с Х-хромосомой, что приводит к преимущественному влиянию на мужчин. Частота рождения мужчин составляет примерно 1 на 3600. [Подробнее: Что такое МДД?]
Эти мутации приводят к деградации скелетных и сердечных мышц, которая проявляется в раннем детстве, несмотря на нормальное развитие опорно-двигательного аппарата. Люди с генотипом DMD обычно теряют способность передвигаться к раннему подростковому возрасту и имеют ожидаемую продолжительность жизни, которая часто заканчивается в возрасте тридцати лет.
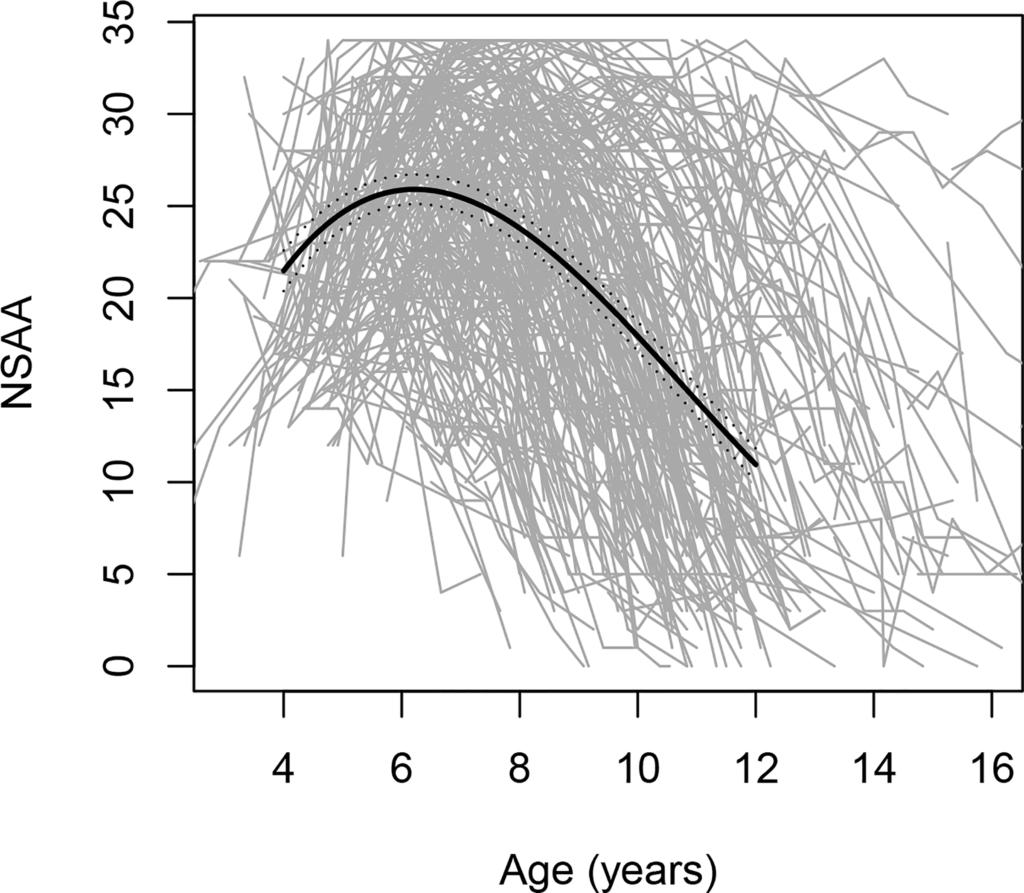
Течение заболевания неоднородно, о чем свидетельствуют данные FDA, указывающие на значительную изменчивость тенденций двигательной функции среди мальчиков с МДД в возрасте 4-16 лет (см. рисунок).
Фигура. Изменения показателей амбулаторной оценки North Star (NSAA), шкалы оценки общей моторики, с возрастом; включает 395 индивидуальных траекторий, каждая из которых обозначена серой линией.
Лекарства от МДД в Сарепте
Деландистроген моксепарвовец-рокл представляет собой первую терапию, изменяющую течение заболевания, для большинства случаев мышечной дистрофии Дюшенна (МДД); однако ранее FDA одобрил четыре препарата для менее распространенных вариантов МДД.
Eteplirsen (Exondys 51) — это исследуемый препарат, разработанный для устранения специфических мутаций МДД с помощью антисмысловых олигонуклеотидов, которые обеспечивают целенаправленный «пропуск экзонов», тем самым обходя мутировавшие области в экспрессии гена в белок. [8]
Существует пять одобренных FDA препаратов для лечения МДД, включая деландистроген моксепарвовек-рокл, все из которых используют укороченные формы основного мышечного белка дистрофина (подробнее см. ниже). [9]
Все эти методы лечения получили одобрение по программе ускоренного одобрения FDA. Несмотря на то, что они использовались у пациентов в течение нескольких лет, большинство из этих методов лечения не показали существенных клинических преимуществ по сравнению с плацебо.
Кроме того, четыре препарата, включая деландистроген моксепарвовек-рокл, производятся одной компанией, Sarepta Therapeutics. [10]
Доктор Роберт Калифф, комиссар FDA во время одобрения как этеплирсена, так и деландистрогена моксепарвовека-рокла, выразил сохраняющуюся обеспокоенность относительно продукции DMD компании Sarepta в 2024 году, заявив: «Sarepta для меня как проклятие».11]
Механизм действия Elevidys
Экспрессия гена, кодирующего белок дистрофин, значительно снижается или полностью прекращается при мутациях, вызывающих МДД.
Многие биохимические компоненты белка пересекают мембраны мышечных клеток. Кроме того, он служит амортизатором, сохраняя мышцы сильными перед лицом потенциального ухудшения, вызванного частыми циклами сокращения-расширения. [12]
Теоретически, МДД можно уменьшить или даже обратить вспять, стимулируя экспрессию дистрофина в мышечных клетках тех, у кого она есть. Деландистроген moxeparvovec-rokl, активный компонент которого представляет собой модифицированную последовательность РНК, кодирующую укороченный вариант дистрофина, известный как «микродистрофин», был разработан в ответ на эту идею.
Микродистрофин имеет размер около 30% немутировавшего дистрофина. Укороченный белок, наблюдаемый у пациентов с более легкой формой мышечной дистрофии Беккера, послужил основой для изобретения микродистрофина, кодируемого деландистрогеном moxeparvovec-rokl.
Поскольку последовательность РНК должна была быть упакована в вирусные капсиды для доставки в организм, ген дистрофина должен был быть усечен. Полная РНК дистрофина превосходит предел емкости таких капсидов.
Деландистроген моксепарвовек-рокл был создан с использованием сложной биоинженерной техники, которая приводит к получению белка, который в лучшем случае лишь частично восстановит функцию дистрофина во всем организме. Эффективность этой сложной терапии еще не была показана в клинических испытаниях.
Ускоренное утверждение 2023 г.
Сорок один амбулаторный ребенок с МДД в возрасте от 4 до 7 лет принял участие в опорном исследовании для первого одобрения деландистрогена моксепарвовека-рокла. Они были рандомизированы 1:1 для получения лекарства или плацебо.
Основным предопределенным клиническим результатом было изменение общей двигательной активности за 48-месячный период, измеренное по 17-пунктовой стандартизированной шкале; у пациентов, получавших лечение деландистрогеном моксепарвовеком-роклом, не наблюдалось значительного улучшения своей активности по сравнению с контрольной группой.13]
На основании суррогатной конечной точки — экспрессии микродистрофина в мышечной ткани — через 12 недель после лечения генной терапией компания Sarepta, спонсор, запросила ускоренное одобрение в связи с неблагоприятным результатом клинического испытания.
Несмотря на то, что экспрессия микродистрофина была отмечена на 12 неделе, не было никакой корреляции между уровнями микродистрофина и последующей мышечной функцией. Следовательно, научные обозреватели FDA пришли к выводу, что не было никакой терапевтической пользы для лечения МДД от исследования деландистрогена моксепарвовека-рокла. Согласно клиническому обзору FDA от 2023 года: [14]
Таким образом, даже для небольшой группы пациентов, например, амбулаторных пациентов с МДД в возрасте от 4 до 5 лет, у которых подтверждена мутация МДД в гене МДД, этих данных недостаточно для поддержки экспрессии микродистрофина ELEVIDYS в качестве суррогатной конечной точки, «достаточно вероятно предсказывающей клиническую пользу» для ускоренного одобрения ELEVIDYS.
Директор Центра оценки и исследований биологических препаратов FDA проигнорировал мнение научных рецензентов агентства и принял решение о быстром одобрении применения препарата у амбулаторных детей в возрасте 4 и 5 лет с МДД, несмотря на эту жесткую критику.
Данные 8 из 41 пациентов послужили первичной основой для решения. Кроме того, спонсору «требовалось в качестве условия ускоренного одобрения» завершить второе рандомизированное исследование, результаты которого ожидались к осени 2023 года, согласно постановлению. [15]
Расширенное одобрение в 2024 году
В пресс-релизе от 30 октября 2023 года компания Sarepta сообщила, что первичная конечная точка второго базового рандомизированного исследования деландистрогена моксепарвовека-рокла не была достигнута.
В этом плацебо-контролируемом исследовании 125 пациентов в возрасте от 4 до 7 лет были случайным образом распределены 1:1 для получения либо плацебо, либо деландистрогена моксепарвовека-рокла. [16]
52-недельное изменение по той же шкале мышечной функции, которая использовалась в предыдущем эксперименте, было главной конечной точкой. Было обнаружено только 0,65-балльное среднее различие между лекарством и плацебо по стандартизированной шкале общей моторной функции (максимальный диапазон которой составляет 34 балла), что делает результаты незначительными (p=0,25).
FDA должен был прекратить одобрение деландистрогена моксепарвовека-рокла там. В одобрении 2023 года производитель вместо этого подчеркнул вторичные результаты, которые, по его словам, дали «надежные, статистически значимые результаты… [которые] подтверждают эффективность добавки».
Научные обозреватели FDA резко отклонили эти новые результаты. В частности, тесты ходьбы/бега на 10 метров и время, необходимое для подъема с пола, были двумя важными вторичными результатами.
Участники, принимавшие деландистроген моксепарвовек-рокл, выполняли эти упражнения в среднем на 0,5 секунды быстрее, чем участники, принимавшие плацебо, которым потребовалось 3,5 и 4,9 секунды в исходном состоянии соответственно.
По мнению рецензентов FDA, эти результаты, которые не были заранее определены и статистически скорректированы для множественного анализа данных, «не могут подтвердить эффективность ELEVIDYS».
По мнению рецензентов FDA, эти данные также «вводят в заблуждение и не могут служить руководством для заинтересованных сторон — включая пациентов, членов их семей, лиц, осуществляющих уход, и лиц, назначающих препараты, — при принятии обоснованных решений о потенциальных преимуществах лечения с помощью ELEVIDYS». [17]
Однако в июне 2024 года директор CBER отменил решение своей команды и одобрил деландистроген моксепарвовек-рокл во второй раз, несмотря на неблагоприятные отзывы ученых FDA. [18]
Как упоминалось ранее, второе одобрение расширило и усилило разрешение, включив типичное одобрение для амбулаторных пациентов с заболеванием в возрасте 4 лет и старше, имеющих подтвержденную мутацию в гене МДД. Кроме того, во второе одобрение было включено ускоренное разрешение для людей, передвигающихся на инвалидной коляске, в возрасте 4 лет и старше. [19]
Косвенное указание на связь между уровнями белка микродистрофина и временем вставания из положения лежа на полу стало основным фактором в меморандуме директора CBER от 2024 года.
Однако эта связь не была ни визуально (графически) убедительной, ни статистически значимой (p=0,1388) из-за слабого наклона (-0,012 секунды на каждый процент изменения уровня микродистрофина в мышцах).
Более того, большое количество точек данных значительно отклонялось от расчетной линии регрессии.
Поскольку в этот анализ были включены только 25% лиц во втором опорном исследовании, эксперты FDA прямо отметили, что результаты следует «интерпретировать с осторожностью» при оценке данных о дозе-реакции микродистрофина. В результате, несмотря на научное обоснование использования вставки гена микродистрофина для лечения МДД, клинические испытания не показали, что генная терапия имеет какие-либо положительные эффекты. [20]
Действительно, «значительные количества» экспрессии микродистрофина были обнаружены в мышцах пациентов с МДД в недавнем исследовании фазы 3 генной терапии МДД, разработанной Pfizer, но не было никакого соразмерного клинического улучшения. Согласно сообщениям, Pfizer прекратил работу над своим лекарством. [21]
Комментарии семьи
Похожие опасения высказывали и те, кто напрямую страдает от МДД. Опасения относительно безопасности и эффективности деландистрогена моксепарвовека-рокла привели к тому, что один из родителей в сентябре 2024 года написал, что решил не проводить терапию для своего ребенка. [22]
В онлайн-видео другой родитель раскритиковал Sarepta за создание недостаточного лекарства, которое скоро устареет. В ответ родительская группа поддержки, разместившая видео, была обвинена в удалении видеокритики delandistrogene moxeparvovec-rokl со своего веб-сайта после того, как Sarepta Therapeutics пригрозил прекратить финансирование группы.23]
Оправдывает ли стоимость Elevidys по сравнению с клиническими испытаниями?
Учитывая результаты клинических испытаний, является ли разумной цена в 3 миллиона долларов США за генную терапию Elevidys? [Подробнее: Мышечная дистрофия Дюшенна: лечение и стоимость]
Учитывая количество дистрофина, вырабатываемого в организме после применения Elevidys, и баллы по шкале амбулаторной оценки North Star (NSAA), изученные в ходе клинических испытаний, 3 миллиона долларов США — это просто непомерная сумма для этого метода лечения.
Наш призыв к компании Sarepta, разработчику Elevidys, и компании Roche, мировому авторитету в маркетинге: Немедленно снизьте эту высокую цену, установленную для этой коммерческой цели!
Узнать больше: Потенциальные новые методы генной терапии мышечной дистрофии Дюшенна
Первое объявление о смерти
18 марта 2025 года Sarepta Therapeutics сообщила, что первый зарегистрированный случай смерти, связанный с их генной терапией мышечной дистрофии Дюшенна, Elevidys, произошел у 16-летнего мальчика. [Читать далее]
Заключение
Директор центра отменил решение научной группы FDA, которой было поручено оценить лекарство, и FDA одобрила деландистроген моксепарвовец-рокл в качестве генной терапии МДД.
Два основных испытания деландистрогена моксепарвовека-рокла не достигли своих основных клинических целей. Индикаторы, используемые для спасения применения деландистрогена моксепарвовека-рокла, такие как вторичные конечные точки (например, тесты ходьбы/бега на 10 метров) и косвенный суррогатный индикатор уровней микродистрофина, были проблематичными сами по себе.
В результате мы считаем, что руководство FDA создало рискованный прецедент, который не защищает общественность от воздействия неэффективного, дорогостоящего и требующего больших физических усилий лекарства. [24]
Узнать больше: Рынок мышечной дистрофии Дюшенна растет: но не все семьи имеют доступ к лечению
Один из способов отреагировать на постановление FDA — это сказать, что проблема заключается в слабых критериях одобрения, а решением являются более строгие стандарты одобрения и процедуры послепродажного контроля. [25]
Внутренние процессы FDA следует изменить, чтобы отдельным должностным лицам на руководящих должностях было гораздо сложнее игнорировать консенсусную оценку ученых агентства, назначенных для принятия регулирующего решения, хотя мы согласны с тем, что необходимы более строгие стандарты одобрения и требования к пострегистрационному периоду.
По словам Кэлифф, комиссара FDA во время принятия двух решений об одобрении деландистрогена моксепарвовека-рокла, те, кто выступает против этого решения, имеют «очень упрощенный взгляд на клинические данные» о трудностях в разработке методов лечения серьезных и редких заболеваний. [26]
Мы не согласны с этой оценкой. FDA должен улучшить процесс принятия решений относительно новых фармацевтических препаратов, будь то для распространенных или редких заболеваний, в результате одобрения деландистрогена моксепарвовека-рокла.
Узнать больше: Представитель DMD WarrioR в Турции делится своими взглядами на генную терапию Elevidys
В интервью перед уходом Кэлифф также обсудил это решение, указав, что семьи с такими тяжелыми и редкими заболеваниями, как и следовало ожидать, жаждали какой-либо надежды, и что как политический назначенец он также не хотел отменять решения, принятые карьерными сотрудниками FDA. Хотя эти факторы значительны, их недостаточно для поддержки решения FDA одобрить деландистроген моксепарвовек-рокл. [27]



