Elevidys ist die weltweit einzige zugelassene Gentherapie für die Muskeldystrophie Duchenne und erhielt im Juni 2023 in den USA eine beschleunigte Zulassung. Inzwischen ist es in den Vereinigten Arabischen Emiraten, Katar, Kuwait, Bahrain, Oman, Brasilien und Israel zur Behandlung gehfähiger Kinder im Alter von 4 bis 5 Jahren mit Duchenne zugelassen, die eine bestätigte Mutation im DMD-Gen aufweisen. [Weiterlesen: Roche gab bekannt, dass EMA eine Überprüfung des ELEVIDYS-]
Sarepta Therapeutics kündigt die Ausweitung der US-Zulassung für FDA im Jahr 2024 auf Elevidys für Patienten mit Muskeldystrophie Duchenne ab 4 Jahren an.
Inhaltsverzeichnis

FDA erweiterte Zulassung der Gentherapie für Patienten mit Duchenne-Muskeldystrophie
Nach dieser Ankündigung erweiterte die US-amerikanische Food and Drug Administration die Zulassung von Elevidys (Delandistrogen Moxeparvovec-Rokl), einer Gentherapie zur Behandlung der Duchenne-Muskeldystrophie (DMD) für gehfähige und nicht gehfähige Personen ab 4 Jahren mit DMD und einer bestätigten Mutation im DMD-Gen. [Weiterlesen: Sarepta erhält vollständige Zulassung und Label-Erweiterung für DMD]
In welchen Ländern ist Elevidys zugelassen?
Die Elevidys-Gentherapie ist jetzt in den USA, den Vereinigten Arabischen Emiraten, Katar, Kuwait, Bahrain, Oman, Brasilien und Israel zugelassen.
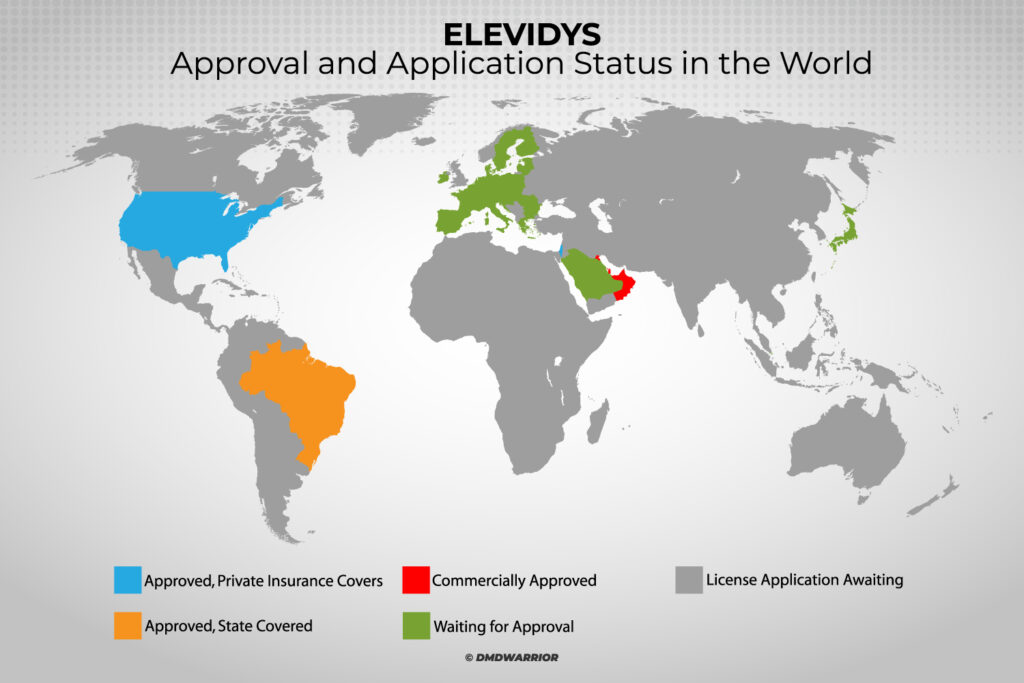
Ist Elevidys in Europa zugelassen?
Roche gibt bekannt, dass EMA mit der Prüfung des Antrags auf Marktzulassung für Elevidys zur Behandlung der Duchenne-Muskeldystrophie (DMD) begonnen hat.
Die Untersuchung von EMA wird in Europa und der Türkei verfolgt. Patienten mit Muskeldystrophie Duchenne und ihre Familien verfolgen die Entwicklungen aufmerksam und warten gespannt auf den Tag, an dem sie das Medikament erhalten.
Zulassungsanträge werden derzeit in Europa (EMA), Japan, der Schweiz, Singapur, Hongkong und Saudi-Arabien geprüft. [Weiterlesen: Roche]
Mehr erfahren: Häufig gestellte Fragen zur Anwendung von Elevidys bei Muskeldystrophie Duchenne
Wird EMA Elevidys nicht genehmigen?
Die Europäische Arzneimittel-Agentur (EMA) forderte eine vorübergehende Aussetzung der Studien 104 (NCT06241950), 302 (ENVOL, NCT06128564) und 303 (ENVISION, NCT05881408) bis zum Abschluss ihrer Untersuchungen aufgrund des Todes eines 16-jährigen Kindes, das die Elevidys-Gentherapie erhalten hatte. (Weiterlesen: Studie 104, Studie 302 und Studie 303 wurden in Europa vorübergehend gestoppt)
Diese Ankündigung, die die europäischen Familien, die auf die Zulassung von Elevidys warten, verärgerte, rief die Annahme hervor, dass die Gentherapie in der Region EMA nicht zugelassen wird, sofern nicht ausreichende Beweise vorgelegt werden.
Mehr entdecken: Muskeldystrophie Duchenne: Behandlung und Kosten


