美国食品药品管理局 (FDA) 周四公布了其在药品被拒后向各公司发送的 200 多封信函,以引起人们对药品审查过程中有时被忽视的部分的关注。 其中一封拒绝信是针对 Vyondys 53(golodirsen)的,这是 Sarepta Therapeutics 生产的一种药物,专门用于外显子 53 跳跃疗法。
该机构只关注那些最终获得批准的制造商的信件,其中大部分信件多年来已经发布。通过将所有信件汇总到一起,该机构声称此举是更广泛提高透明度努力的一部分。
目录
关于 Vyondys 53 的 FDA 拒绝信详情
FDA 于 2019 年发出了针对 Vyondys 53(golodirsen)的拒绝信,Vyondys 53 是一种用于治疗杜氏肌营养不良症的外显子 53 跳跃疗法。 FDA 指出,鉴于该治疗带来的“缩短型肌营养不良蛋白水平的小幅增加”,Vyondys 53 的临床益处可能“相应较小”。
肌营养不良蛋白水平升高千分之九
FDA 的 Vyondys 53(golodirsen)拒绝信指出,使用该药物后肌营养不良蛋白水平略有增加:
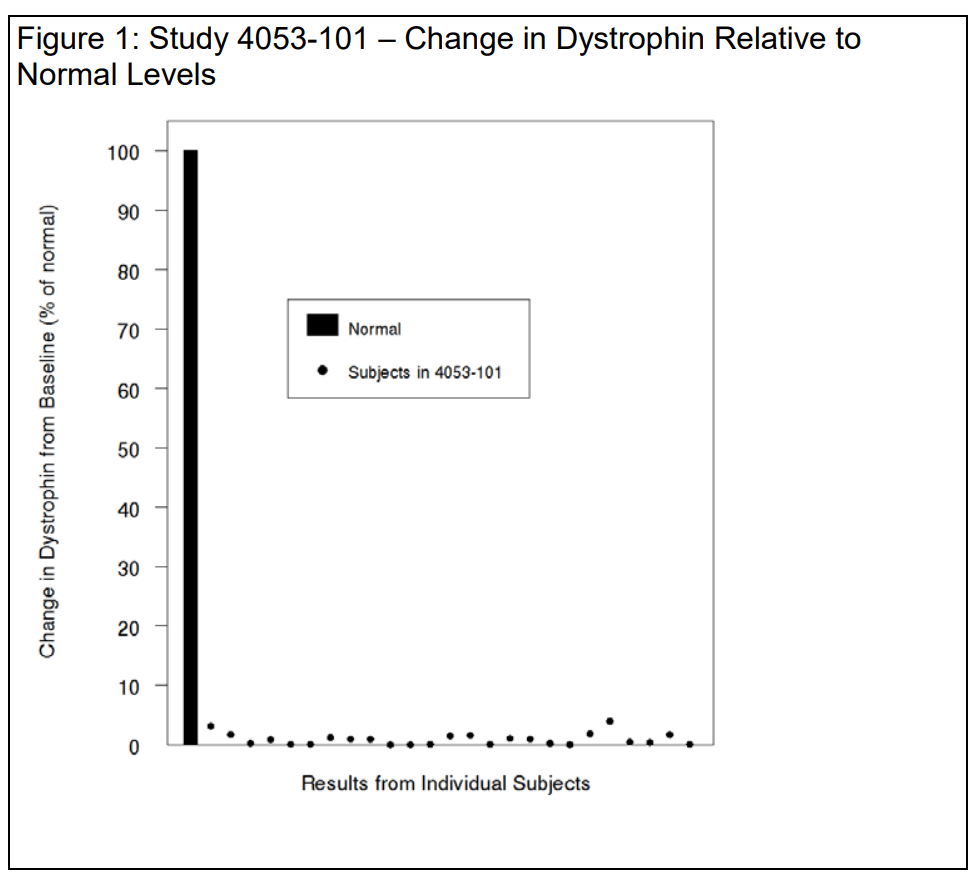
对于研究中的25名可评估患者,通过Western印迹法评估的基线平均肌营养不良蛋白水平为0.10±0.07(正常值百分比;平均值±标准差)。第48周时,平均肌营养不良蛋白水平为1.02±1.03(正常值百分比;平均值±标准差),相当于平均增幅为正常值的0.92±1.01%。
下图1显示了个体肌营养不良蛋白的变化,采用正常值(100%)尺度,以便正确看待数据并避免夸大效应值。您注意到,对于可进行外显子53和外显子跳跃突变的患者,截短型肌营养不良蛋白在戈洛定和eteplirsen治疗后的平均增幅相似——绝对平均增幅为0.9%,即千分之九。我们同意这一观点。
如果人们接受这样的前提,即截短型肌营养不良蛋白的少量增加(大约千分之九)就可能合理地预测临床益处,那么似乎可以合理地假设临床益处会相应较小。
Vyondys 53的临床效果
本文未讨论 4053-101 号研究的 6 分钟步行数据,但数据显示几乎所有男孩的身体功能均逐渐丧失。此外,维持身体机能与肌营养不良蛋白生成减少的程度之间无相关性,这进一步表明,即使戈洛定确实具有临床效果,其效果也较小。
根据 FDA,Vyondys 53 的严重副作用
2019年12月,FDA临床试验批准Sarepta公司的Vyondys 53作为首个针对易受53号外显子跳跃影响的DMD患者的靶向治疗方案。然而,该药物四个月前就被FDA临床试验拒绝,该拒绝由当时担任药物评估与研究中心药物评估办公室主任的埃利斯·昂格尔(Ellis Unger)签署的CRL(注册驳回通知)驳回。
FDA在其驳回理由中指出,考虑到该治疗引起的“截短型肌营养不良蛋白少量增加”,Vyondys 53的治疗效果可能“相应较小”。Unger继续解释说,Vyondys 53在男孩体内产生的肌营养不良蛋白数量与他们的身体机能表现之间“没有关联”,并且“几乎所有”在服用该药物后接受检查的男孩都表现出身体机能逐渐丧失。
仿佛瘀伤还不够,昂格尔列举了Vyondys 53使用者必须面对的一系列安全问题。这些包括“肾毒性”和“与药物输送相关的严重感染”。他声称,这两种情况“都有可能致命”,而后者“难以或无法监测”。
鉴于最近两例与Sarepta基因疗法Elevidys相关的严重肝衰竭死亡病例,这第二次警告尤其令人担忧。正如Unger在信中指出的那样,这两种疗法都与肝脏损害有关,尽管Vyondys 53是一种反义寡核苷酸(ASO),而Elevidys等基因疗法是基于腺相关病毒(AAV)的。
阅读更多: Vyondys 53 FDA 拒绝信
Vyondys 53 是如何获得批准的?
为了解决监管机构在 CRL 中提出的担忧,Sarepta 后来提起上诉,并与 FDA 进行了会面。最终,FDA 当时的新药办公室负责人、于 4 月离职的 Peter Stein 批准了 Vyondys 53。
制药公司不会公布所有信息
FDA 专员 Marty Makary 医学博士、公共卫生硕士表示:“长期以来,药物开发商在 FDA 的审批过程中一直在玩猜谜游戏。药物开发商和资本市场都希望获得可预测性。因此,今天我们距离实现这一目标又近了一步,最终目标是更快地为患者带来治愈方法和有意义的治疗。”
由于FDA历来不愿发布待批申请的CRL,申办方经常向利益相关者和公众歪曲FDA决定背后的理由。根据FDA研究人员在2015年进行的一项分析,申办方在公开宣布其申请未获批准时,避免提及FDA对安全性和有效性的85%个担忧。此外,当FDA需要进行新的安全性或有效性临床试验时,大约有40%个关键信息没有披露。业内人士也未分享未获批准的经验教训,导致公司一再犯类似的错误。——阅读更多: FDA 通过发布完整的回复信来拥抱彻底的透明度 –