药物开发过程非常复杂、漫长且成本高昂,从最初的发现到上市需要很多年,通常需要 10 到 15 年。包括杜氏肌营养不良症的治疗方法在新药向公众推出之前,药物开发涉及多个阶段,每个阶段都经过精心设计,以评估新药的安全性、有效性和潜在风险。药物开发阶段分为临床前研究和临床试验,这是美国食品药品管理局 (FDA) 和欧洲药品管理局 (EMA) 等监管机构的主要关注点。
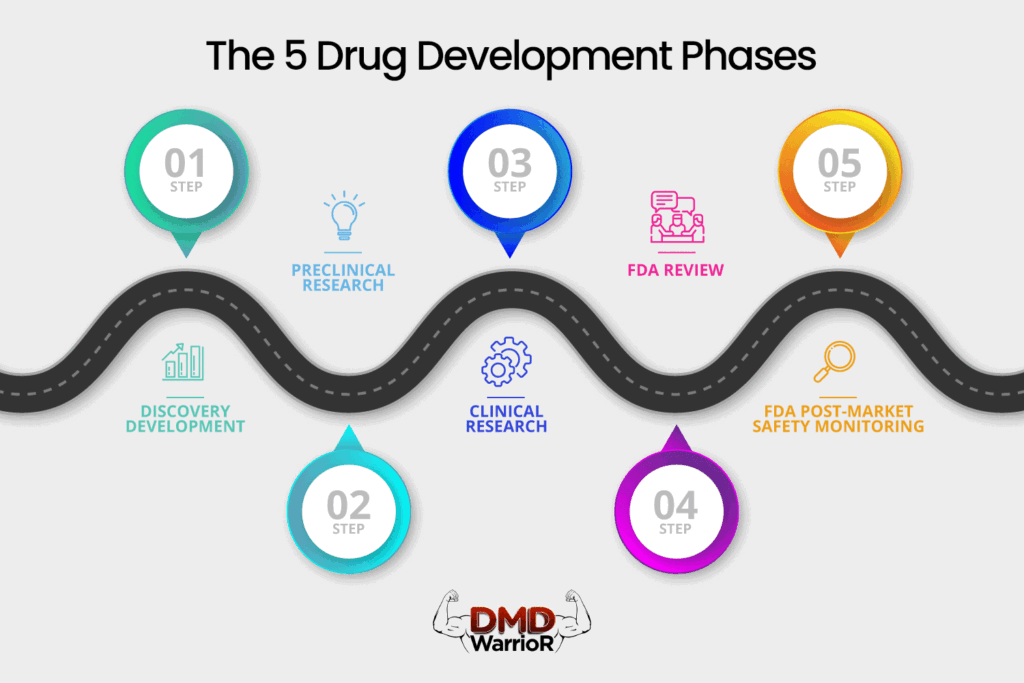
一种新药必须经过五个不同的阶段才能被视为“成功”:1)发现和开发;2)临床前研究;3)临床试验;4)FDA药物审查;5)FDA上市后安全监测。[FDA]
目录
发现与开发
在药物进入临床试验阶段之前,需要进行大量的初步研究。此阶段包括:
- 药物研发:第一步是确定与疾病有关的生物靶点(如蛋白质或基因)。科学家可以筛选大量化合物库,以确定可能影响靶点的候选化合物。然后对这些化合物进行优化,以提高其功效并减少潜在的副作用。
临床前研究
- 临床前: 一旦确定了有希望的化合物,就会对其进行体外(在活体生物体之外)和体内(在活体生物体中,通常是动物)实验室测试,以评估其毒性、药代动力学(药物在体内的吸收、分布、代谢和排泄方式)和药效学(药物对身体的影响方式)。这些研究有助于确定该药物是否可能对人类安全有效。
- 毒理学研究: 在临床前研究期间,科学家会进行详细研究,以评估药物的任何潜在有害影响。目标是确定最大耐受剂量和可能发生的任何不良影响。
如果临床前研究成功,该药物将进入临床试验阶段,包括对人体进行药物测试。
临床试验
什么是1期、2期、3期临床试验?
临床试验过程分为四个不同的阶段(第 1 阶段、第 2 阶段、第 3 阶段和第 4 阶段),以逐步评估药物对人类的安全性、有效性和总体效益风险比。每个阶段在评估过程中都有独特的目的。
第一阶段:安全性和剂量
第 1 阶段是药物在临床前研究后首次进行人体测试。第 1 阶段试验的主要目标是评估药物的安全性、确定安全剂量范围并确定任何副作用。
- 研究设计: 通常,第一阶段试验规模较小,涉及 20 至 100 名健康志愿者或患有疾病/病症的人。这些试验通常在受控的临床环境中进行,例如医院或研究机构。
- 目标:
- 安全:研究人员密切监测志愿者是否出现任何不良反应,从轻微症状到更严重的反应。
- 剂量: 药物的初始剂量通常比较保守。药物剂量会逐渐增加,这个过程称为剂量递增,以确定最大耐受剂量。
- 药代动力学和药效学:研究人员还研究药物在体内如何吸收、分布、代谢和排泄,以及其生物学效应。
- 期间:第一阶段试验通常持续几个月。如果成功,药物将进入第二阶段。
第 2 阶段:疗效和副作用
进行第 2 阶段试验是为了进一步研究该药物对患有该药物所要治疗的疾病或病症的特定患者群体的疗效和安全性。
- 研究设计:这些试验通常比第一阶段规模更大,涉及 100 至 300 名参与者。重点是测试药物对患者的有效性并确定长期使用相关的任何不良反应。
- 目标:
- 功效:研究人员旨在确定药物是否对目标疾病患者产生预期的治疗效果。疗效通过临床结果来衡量,例如症状或疾病生物标志物的改善。
- 安全:与第 1 阶段类似,研究人员继续监测安全性,但主要目标是确定患有该疾病的患者可能出现的任何副作用。
- 最佳剂量:在第 2 阶段,研究人员根据第 1 阶段获得的信息进一步完善药物的给药方案。
- 期间:第 2 阶段试验通常持续数月至数年。如果药物显示出疗效和良好的安全性,则将进入第 3 阶段。
第 3 阶段:确认试验(疗效和安全性)
第三阶段试验是一项大规模研究,旨在确认药物的疗效、监测其副作用,并将其与现有治疗方法或安慰剂进行比较。这一阶段在确定药物是否应获得监管机构批准使用方面起着关键作用。
- 研究设计:第 3 阶段试验涉及的参与者数量要多得多,通常为 1,000 至 3,000 人或更多。这些试验通常是多中心的,这意味着它们在多个地点进行,有时甚至在国际上进行。
- 目标:
- 功效:目标是确认该药物比现有治疗方法或安慰剂具有显著的临床益处。
- 安全:研究人员继续监测副作用,但更大的样本量有助于识别早期阶段可能被忽视的不太常见的不良事件。
- 比较有效性:第 3 阶段试验通常将新药与标准治疗或安慰剂进行比较,以证明其优越性或非劣效性。
- 期间:由于需要大量数据收集,第 3 阶段试验可能持续数年。这些试验通常是药物开发过程中最昂贵且最耗时的部分。
- 最终结果:如果第 3 阶段试验成功,药物赞助商可以向监管机构提交新药申请 (NDA) 或生物制品许可申请 (BLA),例如 FDA 或 EMA。如果获得批准,药物将进入最后阶段: 第四阶段.
FDA 药物审查
药物化合物通过第 1 阶段、第 2 阶段、第 3 阶段和第 4 阶段临床试验后,其安全性和有效性结果将由由医生、化学家、统计学家、微生物学家和药理学家组成的专家小组进行审查。
生物技术或制药公司必须提交生物制品许可申请 (BLA) 或药品新药申请 (NDA) 才能申请 FDA 评估。之后,FDA 必须批准该申请并指定一组专业人员评估其优缺点。
该小组共同审查临床研究,同时考虑药物的风险效益分析、可能的副作用和患者结果。如果该药物被判定为安全且有效,则 FDA 授权该药物在美国制造、营销和分销。
FDA 上市后安全监测
一旦药物获得监管机构的批准,它就会进入上市后阶段,也称为第 4 阶段。在此阶段,药物可供一般人群使用,但研究人员会继续监测其长期安全性、有效性以及任何罕见或长期副作用。
- 上市后监测:在第 4 阶段,正在进行的研究和患者报告(例如来自不良事件报告系统)有助于识别在早期试验中可能未检测到的任何罕见副作用。
- 真实世界数据:研究人员还收集药物在现实环境和临床试验中可能没有得到充分体现的不同人群中的表现数据。
了解更多: 杜氏肌营养不良症的治疗方法(所有研究列表)
结论:药物开发中每个阶段的重要性
临床药物开发的每个阶段都发挥着至关重要的作用,以确保新药在上市前既安全又有效。从以安全性为首要考虑的第一阶段,到在大量患者群体中严格测试药物总体效益风险比的第三阶段,再到监测上市后长期效果的第四阶段,每个阶段都有助于加深对药物将如何影响患者的了解。
整个药物开发过程是一项复杂的平衡工作,制药公司、监管机构和研究人员共同努力,将创新和改变生活的治疗方法推向市场,同时将潜在危害降至最低。药物开发投入的时间、精力和成本是巨大的,但它们对于推动医学科学发展和改善全球患者治疗效果至关重要。



