O processo de desenvolvimento de medicamentos é uma jornada altamente intrincada, longa e custosa que abrange muitos anos, normalmente entre 10 a 15 anos, desde a descoberta inicial até o lançamento no mercado. Incluindo curas para Distrofia Muscular de Duchenne. Envolve vários estágios, cada um cuidadosamente projetado para avaliar a segurança, eficácia e riscos potenciais de um novo medicamento antes que ele possa ser disponibilizado ao público em geral. Os estágios do desenvolvimento de medicamentos são divididos em pesquisa pré-clínica e ensaios clínicos, que são o foco principal de agências reguladoras como a Food and Drug Administration (FDA) e a European Medicines Agency (EMA).
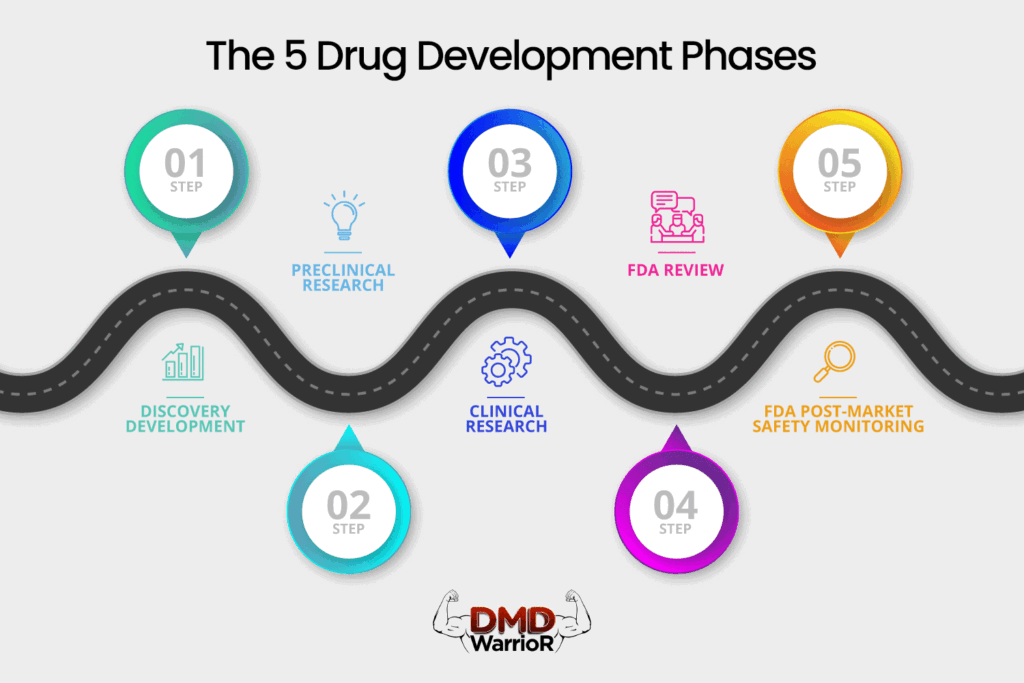
Um novo medicamento deve passar por cinco estágios distintos para ser considerado um “sucesso”: 1) Descoberta e Desenvolvimento; 2) Pesquisa Pré-clínica; 3) Ensaios Clínicos; 4) Revisão do Medicamento FDA; e 5) Monitoramento de Segurança Pós-Comercialização FDA. [FDA]
Índice
Descoberta e Desenvolvimento
Antes mesmo de um medicamento entrar na fase de teste clínico, há uma quantidade significativa de pesquisa preliminar que ocorre. Esta fase inclui:
- Descoberta de Medicamentos: A etapa inicial envolve a identificação de um alvo biológico (como uma proteína ou gene) que esteja envolvido em uma doença. Cientistas podem rastrear grandes bibliotecas de compostos para identificar candidatos que possam afetar o alvo. Esses compostos são então otimizados para melhorar sua eficácia e reduzir potenciais efeitos colaterais.
Pesquisa pré-clínica
- Pré-clínico: Uma vez que um composto promissor é identificado, ele passa por testes laboratoriais in vitro (fora de um organismo vivo) e in vivo (em organismos vivos, tipicamente animais) para avaliar sua toxicidade, farmacocinética (como o medicamento é absorvido, distribuído, metabolizado e excretado no corpo) e farmacodinâmica (como o medicamento afeta o corpo). Esses estudos ajudam a determinar se o medicamento provavelmente é seguro e eficaz em humanos.
- Estudos de Toxicologia: Durante a pesquisa pré-clínica, os cientistas conduzem estudos detalhados para avaliar quaisquer efeitos nocivos potenciais do medicamento. O objetivo é identificar a dose máxima tolerada e quaisquer efeitos adversos que possam ocorrer.
Se os estudos pré-clínicos forem bem-sucedidos, o medicamento passa para a fase de ensaios clínicos, que envolve testá-lo em humanos.
Ensaios clínicos
O que são ensaios clínicos de fase 1, fase 2 e fase 3?
O processo de ensaio clínico é dividido em quatro fases distintas (Fase 1, Fase 2, Fase 3 e Fase 4) para avaliar progressivamente a segurança, eficácia e relação risco-benefício geral de um medicamento em humanos. Cada fase atende a um propósito único no processo de avaliação.
Fase 1: Segurança e dosagem
A Fase 1 é a primeira vez que o medicamento é testado em humanos após a pesquisa pré-clínica. O principal objetivo dos ensaios da Fase 1 é avaliar o perfil de segurança do medicamento, determinar uma faixa de dosagem segura e identificar quaisquer efeitos colaterais.
- Desenho do estudo: Normalmente, os ensaios de Fase 1 são pequenos, envolvendo de 20 a 100 voluntários saudáveis ou pessoas com a doença/condição. Esses ensaios geralmente são conduzidos em um ambiente clínico controlado, como um hospital ou instalação de pesquisa.
- Objetivos:
- Segurança: Os pesquisadores monitoram os voluntários de perto para detectar quaisquer efeitos adversos, desde sintomas leves até reações mais graves.
- Dosagem: A dosagem inicial do medicamento é frequentemente conservadora. O medicamento é gradualmente escalonado em um processo conhecido como escalonamento de dose para determinar a dose máxima tolerada.
- Farmacocinética e Farmacodinâmica:Os pesquisadores também estudam como o medicamento é absorvido, distribuído, metabolizado e excretado pelo corpo, bem como seus efeitos biológicos.
- Duração: Os ensaios de Fase 1 geralmente duram alguns meses. Se bem-sucedidos, o medicamento passa para a Fase 2.
Fase 2: Eficácia e efeitos colaterais
Os ensaios de fase 2 são conduzidos para investigar mais a fundo a eficácia e a segurança do medicamento em uma população específica de pacientes que têm a doença ou condição que o medicamento pretende tratar.
- Desenho do estudo: Esses ensaios são geralmente maiores que a Fase 1, envolvendo de 100 a 300 participantes. O foco é testar a eficácia do medicamento em pacientes e identificar quaisquer efeitos adversos associados ao uso a longo prazo.
- Objetivos:
- Eficácia: Os pesquisadores visam determinar se o medicamento produz o efeito terapêutico desejado em pacientes com a condição alvo. A eficácia é medida por meio de resultados clínicos, como melhora nos sintomas ou biomarcadores da doença.
- Segurança: Semelhante à Fase 1, os pesquisadores continuam monitorando a segurança, mas o objetivo principal é identificar quaisquer efeitos colaterais que possam surgir em pacientes com a doença.
- Dose Ótima:Durante a Fase 2, os pesquisadores refinam ainda mais o regime de dosagem do medicamento com base nas informações obtidas na Fase 1.
- Duração: Os ensaios de Fase 2 geralmente duram de vários meses a alguns anos. Se o medicamento mostrar eficácia e um perfil de segurança favorável, ele progride para a Fase 3.
Fase 3: Ensaios confirmatórios (eficácia e segurança)
Os ensaios de fase 3 são estudos em larga escala projetados para confirmar a eficácia do medicamento, monitorar seus efeitos colaterais e compará-lo a tratamentos existentes ou a um placebo. Esta fase desempenha um papel crítico na determinação se o medicamento deve ser aprovado para uso por autoridades regulatórias.
- Desenho do estudo: Os ensaios de fase 3 envolvem um número muito maior de participantes, geralmente variando de 1.000 a 3.000 ou mais. Esses ensaios são frequentemente multicêntricos, o que significa que são conduzidos em vários locais e, às vezes, até internacionalmente.
- Objetivos:
- Eficácia:O objetivo é confirmar se o medicamento proporciona um benefício clinicamente significativo em relação aos tratamentos existentes ou a um placebo.
- Segurança: Os pesquisadores continuam monitorando os efeitos colaterais, mas o tamanho maior da amostra ajuda a identificar eventos adversos menos comuns que podem ter passado despercebidos em fases anteriores.
- Eficácia comparativa:Os ensaios de fase 3 geralmente comparam o novo medicamento com tratamentos padrão ou placebos para demonstrar sua superioridade ou não inferioridade.
- Duração: Os ensaios de fase 3 podem durar vários anos devido à extensa coleta de dados necessária. Esses ensaios são frequentemente a parte mais cara e demorada do processo de desenvolvimento de medicamentos.
- Resultado final: Se um teste de Fase 3 for bem-sucedido, o patrocinador do medicamento pode enviar um New Drug Application (NDA) ou Biologics License Application (BLA) para autoridades regulatórias como o FDA ou EMA. Se aprovado, o medicamento passa para a fase final: Fase 4.
Revisão do medicamento FDA
Os resultados de segurança e eficácia de um composto medicamentoso em ensaios clínicos são revisados por um painel de especialistas que inclui médicos, químicos, estatísticos, microbiologistas e farmacologistas depois que ele passa pelos ensaios clínicos de fase 1, fase 2, fase 3 e fase 4.
Uma empresa de biotecnologia ou farmacêutica deve registrar um Biologics License Application (BLA) para produtos biológicos ou um New Drug Application (NDA) para medicamentos para solicitar a avaliação FDA. Depois disso, o FDA tem que aprovar o requerimento e designar um grupo de profissionais para avaliar seus méritos.
O grupo examina o estudo clínico em conjunto, levando em conta a análise de risco-benefício do medicamento, possíveis efeitos colaterais e resultados do paciente. O FDA autoriza a fabricação, o marketing e a distribuição do medicamento nos EUA se ele for considerado seguro e eficaz para o uso pretendido.
Monitoramento de segurança pós-comercialização FDA
Depois que um medicamento é aprovado pelas agências reguladoras, ele entra na fase de pós-comercialização, também conhecida como Fase 4. Nessa fase, o medicamento fica disponível para uso pela população em geral, mas os pesquisadores continuam monitorando sua segurança a longo prazo, eficácia e quaisquer efeitos colaterais raros ou de longo prazo.
- Vigilância Pós-Comercialização:Na Fase 4, estudos em andamento e relatórios de pacientes (como os de sistemas de notificação de eventos adversos) ajudam a identificar quaisquer efeitos colaterais raros que podem não ter sido detectados durante os ensaios anteriores.
- Dados do mundo real: Os pesquisadores também coletam dados sobre o desempenho do medicamento em cenários do mundo real e em populações diversas que podem não ter sido adequadamente representadas em ensaios clínicos.
Saber mais: Curas de Duchenne (Lista de todas as pesquisas)
Conclusão: A importância de cada fase no desenvolvimento de medicamentos
Cada fase do desenvolvimento clínico de medicamentos desempenha um papel crucial para garantir que um novo medicamento seja seguro e eficaz antes de chegar ao mercado. Da Fase 1, onde a segurança é a principal preocupação, à Fase 3, que testa rigorosamente a relação risco-benefício geral de um medicamento em uma grande população de pacientes, e a Fase 4, que monitora os efeitos de longo prazo pós-mercado, cada fase contribui para a compreensão de como o medicamento impactará os pacientes.
O processo geral de desenvolvimento de medicamentos é um ato de equilíbrio complexo, pois empresas farmacêuticas, órgãos reguladores e pesquisadores trabalham juntos para trazer tratamentos inovadores e transformadores ao mercado, ao mesmo tempo em que minimizam danos potenciais. O tempo, o esforço e os custos investidos no desenvolvimento de medicamentos são substanciais, mas são essenciais para o avanço da ciência médica e a melhoria dos resultados dos pacientes em todo o mundo.



