Elevidys es la única terapia génica aprobada en el mundo para la distrofia muscular de Duchenne y recibió aprobación acelerada en los EE. UU. en junio de 2023, y ahora está aprobada en los Emiratos Árabes Unidos, Qatar, Kuwait, Bahréin, Omán, Brasil e Israel para el tratamiento de niños ambulatorios de 4 a 5 años con Duchenne, que tienen una mutación confirmada en el gen DMD. [Leer más: Roche anunció que EMA ha iniciado la revisión del ELEVIDYS]
Sarepta Therapeutics anuncia la expansión de la aprobación de FDA en EE. UU. en 2024 para Elevidys para pacientes con distrofia muscular de Duchenne de 4 años o más.
Tabla de contenido

FDA Aprobación ampliada de terapia génica para pacientes con distrofia muscular de Duchenne
Tras este anuncio, la Administración de Alimentos y Medicamentos de Estados Unidos amplió la aprobación de Elevidys (delandistrógeno moxeparvovec-rokl), una terapia génica para el tratamiento de la distrofia muscular de Duchenne (DMD) para individuos ambulatorios y no ambulatorios de 4 años de edad o más con DMD con una mutación confirmada en el gen DMD. [Leer más: Sarepta obtiene la aprobación total y la ampliación de la etiqueta para DMD]
¿En qué países está aprobado el Elevidys?
La terapia genética Elevidys ahora aprobada en EE. UU., Emiratos Árabes Unidos, Qatar, Kuwait, Bahréin, Omán, Brasil e Israel.
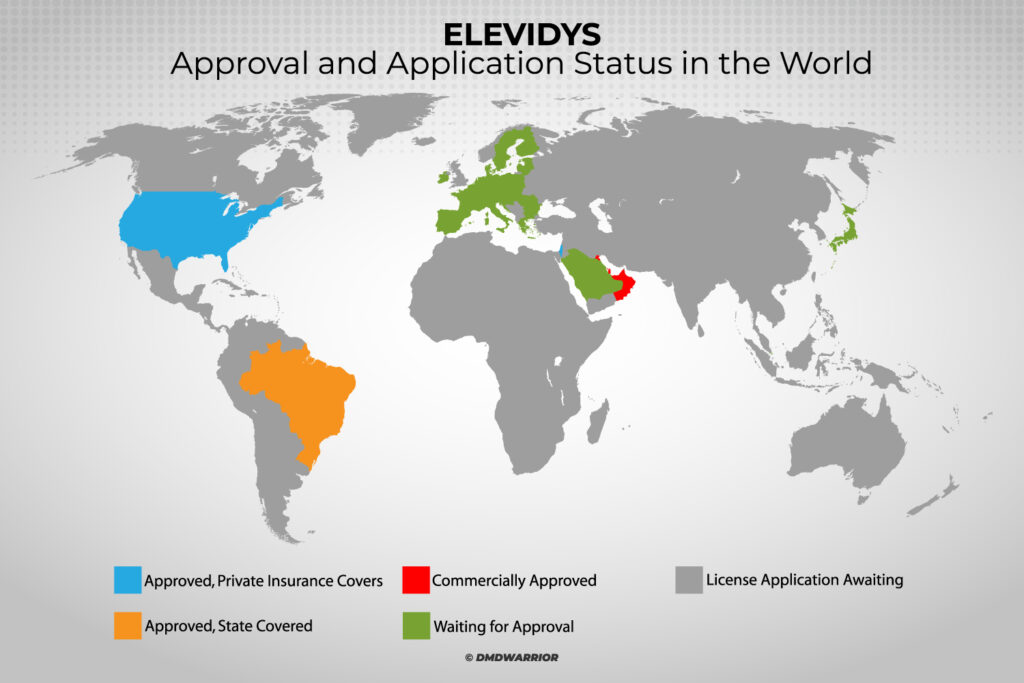
¿EMA no aprobará Elevidys?
La Agencia Europea de Medicamentos (EMA) solicitó la suspensión temporal de los estudios 104 (NCT06241950), 302 (ENVOL, NCT06128564) y 303 (ENVISION, NCT05881408) a la espera de la finalización de su investigación debido al fallecimiento de un menor de 16 años que recibió terapia génica con Elevidys. (Leer más: Los estudios 104, 302 y 303 se suspendieron temporalmente en Europa.)
Descubra más: Distrofia muscular de Duchenne: tratamiento y costo
¿Está aprobado el Elevidys en Europa?
El comité de la Agencia Europea de Medicamentos dictaminó que la terapia, denominada Elevidys, no demostró en estudios que mejorara las capacidades de movimiento de los pacientes. La Agencia Europea de Medicamentos ha recomendado denegar la autorización de comercialización de Elevidys, un medicamento destinado al tratamiento de la distrofia muscular de Duchenne. - Leer más: La Agencia Europea de Medicamentos (EMA) emitió una opinión negativa sobre Elevidys –
Actualmente se están revisando las solicitudes de aprobación en Suiza, Singapur, Hong Kong y Arabia Saudita. [Leer más: Roche]
Más información: Preguntas frecuentes sobre el uso de Elevidys para la distrofia muscular de Duchenne



