Der Prozess der Arzneimittelentwicklung ist ein hochkomplexer, langwieriger und kostspieliger Prozess, der von der Entdeckung bis zur Markteinführung viele Jahre, in der Regel 10 bis 15 Jahre, umfasst. Dies gilt auch für die Entwicklung von Heilmitteln für die Muskeldystrophie Duchenne. Er umfasst mehrere Phasen, die jeweils sorgfältig darauf ausgelegt sind, die Sicherheit, Wirksamkeit und potenziellen Risiken eines neuen Medikaments zu bewerten, bevor es der breiten Öffentlichkeit zugänglich gemacht werden kann. Die Phasen der Arzneimittelentwicklung gliedern sich in präklinische Forschung und klinische Studien, die im Mittelpunkt der Aufsichtsbehörden wie der Food and Drug Administration (FDA) und der Europäischen Arzneimittel-Agentur (EMA) stehen.
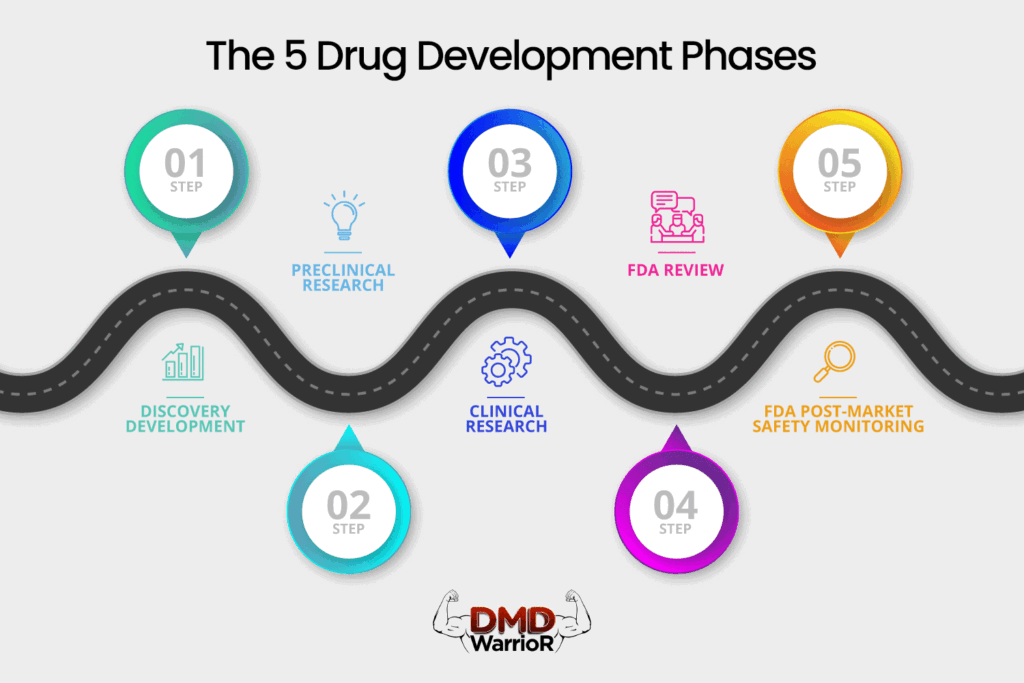
Ein neues Medikament muss fünf verschiedene Phasen durchlaufen, um als „erfolgreich“ zu gelten: 1) Entdeckung und Entwicklung; 2) Präklinische Forschung; 3) Klinische Studien; 4) FDA-Arzneimittelprüfung; und 5) FDA-Sicherheitsüberwachung nach der Markteinführung. [FDA]
Inhaltsverzeichnis
Entdeckung und Entwicklung
Bevor ein Medikament überhaupt in die klinische Testphase eintritt, wird eine umfangreiche Vorforschung durchgeführt. Diese Phase umfasst:
- Arzneimittelforschung: Der erste Schritt besteht darin, ein biologisches Ziel (wie ein Protein oder Gen) zu identifizieren, das an einer Krankheit beteiligt ist. Wissenschaftler können große Substanzbibliotheken durchsuchen, um Kandidaten zu identifizieren, die das Ziel beeinflussen könnten. Diese Substanzen werden dann optimiert, um ihre Wirksamkeit zu verbessern und potenzielle Nebenwirkungen zu reduzieren.
Präklinische Forschung
- Präklinisch: Sobald eine vielversprechende Verbindung identifiziert ist, wird sie in vitro (außerhalb eines lebenden Organismus) und in vivo (an lebenden Organismen, typischerweise Tieren) Labortests unterzogen, um ihre Toxizität, Pharmakokinetik (Aufnahme, Verteilung, Metabolisierung und Ausscheidung des Arzneimittels im Körper) und Pharmakodynamik (Wirkung des Arzneimittels auf den Körper) zu untersuchen. Diese Studien helfen festzustellen, ob das Arzneimittel für den Menschen wahrscheinlich sicher und wirksam ist.
- Toxikologische Studien: In der präklinischen Forschung führen Wissenschaftler detaillierte Studien durch, um mögliche schädliche Auswirkungen des Medikaments zu bewerten. Ziel ist es, die maximal verträgliche Dosis und mögliche Nebenwirkungen zu ermitteln.
Wenn die präklinischen Studien erfolgreich sind, geht das Medikament in die klinische Testphase über, in der es an Menschen getestet wird.
Klinische Studien
Was sind klinische Studien der Phase 1, Phase 2 und Phase 3?
Der klinische Prüfprozess ist in vier Phasen (Phase 1, Phase 2, Phase 3 und Phase 4) unterteilt, um die Sicherheit, Wirksamkeit und das Nutzen-Risiko-Verhältnis eines Arzneimittels beim Menschen schrittweise zu bewerten. Jede Phase dient einem bestimmten Zweck im Bewertungsprozess.
Phase 1: Sicherheit und Dosierung
In Phase 1 wird das Medikament nach präklinischer Forschung erstmals am Menschen getestet. Hauptziel der Phase-1-Studien ist die Bewertung des Sicherheitsprofils des Medikaments, die Bestimmung eines sicheren Dosierungsbereichs und die Identifizierung möglicher Nebenwirkungen.
- Studiendesign: Phase-1-Studien sind typischerweise klein und umfassen 20 bis 100 gesunde Freiwillige oder Personen mit der Krankheit/Beschwerde. Diese Studien werden üblicherweise in einer kontrollierten klinischen Umgebung wie einem Krankenhaus oder einer Forschungseinrichtung durchgeführt.
- Ziele:
- Sicherheit: Die Forscher überwachen die Freiwilligen genau auf etwaige Nebenwirkungen, die von leichten Symptomen bis hin zu schwerwiegenderen Reaktionen reichen.
- Dosierung: Die anfängliche Dosierung des Arzneimittels ist oft konservativ. Das Arzneimittel wird in einem als Dosiseskalation bezeichneten Prozess schrittweise erhöht, um die maximal verträgliche Dosis zu bestimmen.
- Pharmakokinetik und Pharmakodynamik: Die Forscher untersuchen auch, wie das Medikament vom Körper aufgenommen, verteilt, verstoffwechselt und ausgeschieden wird, sowie seine biologischen Wirkungen.
- Dauer: Phase-1-Studien dauern in der Regel einige Monate. Bei Erfolg geht das Medikament in Phase 2 über.
Phase 2: Wirksamkeit und Nebenwirkungen
In Phase-2-Studien wird die Wirksamkeit und Sicherheit des Arzneimittels bei einer bestimmten Patientengruppe, die an der Krankheit oder dem Leiden leidet, das mit dem Arzneimittel behandelt werden soll, weiter untersucht.
- Studiendesign: Diese Studien sind in der Regel umfangreicher als Phase 1 und umfassen 100 bis 300 Teilnehmer. Der Schwerpunkt liegt darauf, die Wirksamkeit des Medikaments bei Patienten zu testen und etwaige Nebenwirkungen bei Langzeitanwendung zu identifizieren.
- Ziele:
- Wirksamkeit: Forscher wollen herausfinden, ob das Medikament bei Patienten mit der Zielerkrankung die gewünschte therapeutische Wirkung erzielt. Die Wirksamkeit wird anhand klinischer Ergebnisse wie der Verbesserung von Symptomen oder Krankheitsbiomarkern gemessen.
- Sicherheit: Ähnlich wie in Phase 1 überwachen die Forscher weiterhin die Sicherheit, das Hauptziel besteht jedoch darin, etwaige Nebenwirkungen zu identifizieren, die bei Patienten mit der Krankheit auftreten können.
- Optimale Dosis: Während Phase 2 verfeinern die Forscher das Dosierungsschema des Medikaments auf der Grundlage der in Phase 1 gewonnenen Informationen weiter.
- Dauer: Phase-2-Studien dauern in der Regel mehrere Monate bis einige Jahre. Zeigt das Medikament Wirksamkeit und ein günstiges Sicherheitsprofil, geht es in Phase 3 über.
Phase 3: Bestätigungsstudien (Wirksamkeit und Sicherheit)
Phase-3-Studien sind groß angelegte Studien, die die Wirksamkeit des Medikaments bestätigen, seine Nebenwirkungen überwachen und es mit bestehenden Behandlungen oder einem Placebo vergleichen. Diese Phase spielt eine entscheidende Rolle bei der Entscheidung, ob das Medikament von den Zulassungsbehörden zugelassen werden sollte.
- Studiendesign: An Phase-3-Studien nehmen deutlich mehr Teilnehmer teil, typischerweise zwischen 1.000 und 3.000 oder mehr. Diese Studien werden oft multizentrisch durchgeführt, d. h. an mehreren Standorten und manchmal sogar international.
- Ziele:
- Wirksamkeit: Ziel ist es, zu bestätigen, dass das Medikament einen klinisch signifikanten Nutzen gegenüber bestehenden Behandlungen oder einem Placebo bietet.
- Sicherheit: Die Forscher überwachen die Nebenwirkungen weiterhin, aber die größere Stichprobengröße hilft dabei, weniger häufige unerwünschte Ereignisse zu identifizieren, die in früheren Phasen möglicherweise übersehen wurden.
- Vergleichende Wirksamkeit: In Phase-3-Studien wird das neue Medikament häufig mit Standardbehandlungen oder Placebos verglichen, um seine Überlegenheit oder Nichtunterlegenheit nachzuweisen.
- Dauer: Phase-3-Studien können aufgrund der erforderlichen umfangreichen Datenerhebung mehrere Jahre dauern. Diese Studien sind oft der teuerste und zeitaufwändigste Teil des Arzneimittelentwicklungsprozesses.
- Endergebnis: Wenn eine Phase-3-Studie erfolgreich ist, kann der Arzneimittelsponsor einen Antrag auf Zulassung eines neuen Arzneimittels (NDA) oder eine Zulassung für ein biologisches Präparat (BLA) bei den zuständigen Behörden wie FDA oder EMA einreichen. Bei Genehmigung tritt das Medikament in die letzte Phase ein: Phase 4.
FDA Arzneimittelüberprüfung
Die Ergebnisse klinischer Studien zu Sicherheit und Wirksamkeit eines Arzneimittels werden von einem Expertengremium aus Ärzten, Chemikern, Statistikern, Mikrobiologen und Pharmakologen überprüft, nachdem das Arzneimittel die klinischen Studien der Phasen 1, 2, 3 und 4 durchlaufen hat.
Ein Biotechnologie- oder Pharmaunternehmen muss für Biologika einen Zulassungsantrag (Biologics License Application, BLA) oder für Arzneimittel einen Zulassungsantrag (New Drug Application, NDA) einreichen, um eine FDA-Bewertung zu beantragen. Anschließend muss die FDA den Antrag genehmigen und eine Expertengruppe zur Bewertung benennen.
Die Gruppe prüft die klinische Studie gemeinsam und berücksichtigt dabei die Nutzen-Risiko-Analyse des Medikaments, mögliche Nebenwirkungen und Patientenergebnisse. Die FDA-Zulassung genehmigt die Herstellung, Vermarktung und den Vertrieb des Medikaments in den USA, wenn es für den vorgesehenen Anwendungszweck als sicher und wirksam eingestuft wird.
FDA Sicherheitsüberwachung nach der Markteinführung
Sobald ein Medikament von den Zulassungsbehörden zugelassen wurde, beginnt die Phase nach der Markteinführung, auch Phase 4 genannt. In dieser Phase steht das Medikament der breiten Bevölkerung zur Verfügung, die Forscher überwachen jedoch weiterhin seine langfristige Sicherheit, Wirksamkeit und etwaige seltene oder langfristige Nebenwirkungen.
- Überwachung nach der Markteinführung: In Phase 4 helfen laufende Studien und Patientenberichte (z. B. aus Meldesystemen für unerwünschte Ereignisse) dabei, seltene Nebenwirkungen zu identifizieren, die bei früheren Studien möglicherweise nicht erkannt wurden.
- Daten aus der realen Welt: Forscher sammeln auch Daten darüber, wie das Medikament in realen Umgebungen und bei verschiedenen Bevölkerungsgruppen wirkt, die in klinischen Studien möglicherweise nicht ausreichend vertreten waren.
Mehr erfahren: Heilungen von Duchenne (Liste aller Untersuchungen)
Fazit: Die Bedeutung jeder Phase der Arzneimittelentwicklung
Jede Phase der klinischen Arzneimittelentwicklung trägt entscheidend dazu bei, die Sicherheit und Wirksamkeit eines neuen Medikaments vor Markteinführung zu gewährleisten. Von Phase 1, in der die Sicherheit im Vordergrund steht, über Phase 3, in der das Nutzen-Risiko-Verhältnis eines Medikaments an einer großen Patientenpopulation rigoros getestet wird, bis hin zu Phase 4, in der die Langzeitwirkungen nach der Markteinführung überwacht werden, trägt jede Phase zum Verständnis der Auswirkungen des Medikaments auf die Patienten bei.
Der gesamte Prozess der Arzneimittelentwicklung ist ein komplexer Balanceakt, da Pharmaunternehmen, Aufsichtsbehörden und Forscher zusammenarbeiten, um innovative und lebensverändernde Behandlungen auf den Markt zu bringen und gleichzeitig potenzielle Schäden zu minimieren. Der Zeit-, Arbeits- und Kostenaufwand für die Arzneimittelentwicklung ist beträchtlich, aber sie ist unerlässlich für den Fortschritt der Medizinwissenschaft und die Verbesserung der Patientenergebnisse weltweit.



