İlaç pazarına sunulan ELEVIDYS (delandistrogene moxeparvovec-rokl) gen terapisi, 3 milyon Amerikan Doları maliyetine kıyasla ne kadar etkilidir? Elevidys Gen Terapisinin klinik deneme incelemesi bu makalenin ana konusu olacaktır. Duchenne kas distrofisini tedavi etmek için geliştirilen bu gen terapisinin maliyetini ve etkinliğini değerlendireceğiz. Elevidys Klinik Çalışmalarla Karşılaştırıldığında Fiyatı Açısından Uygun Mu?
İçindekiler
Klinik Araştırmalara Genel Bakış
Gıda ve İlaç Dairesi (FDA), 2023 ve 2024 yıllarında nadir görülen ancak ölümcül çocukluk çağı başlangıçlı Duchenne kas distrofisi hastalığı için devrim niteliğinde bir gen terapisini onayladı.
2023 izninden sadece yürüyebilen (ambulatuvar) 4-5 yaş aralığındaki gençler yararlanabiliyordu.
2024 tarihli karar, bu izni, 4 yaş ve üzeri, DMD geninde mutasyonu doğrulanmış ve bu rahatsızlığı yaşayan ayaktan hastalar için konvansiyonel onayı kapsayacak şekilde genişletti.
Ayrıca FDA, tekerlekli sandalyeye bağımlı 4 yaş ve üzeri kişiler için hızlandırılmış onay sağlamıştır.
Bu onaylardan hiçbiri, DMD'li çocukların kaba motor becerilerini koruduğunu veya geri kazandırdığını gösteren uygun klinik deney sonuçları veya olumlu FDA bilimsel değerlendirmeleri tarafından desteklenmemiştir.
FDA direktörü, kurumun bilimsel kadrosunu dikkate almadığı için her iki onay da alındı.
Bu makalede, iyi düşünülmemiş iki onay, FDA liderlerinin gelecekte neden bu örüntüyü takip etmemesi gerektiğiyle birlikte tartışılmaktadır. Ayrıca, FDA'nin tartışmalı düzenleyici kararları ele alma biçimini nasıl değiştirebileceğine dair öneriler de sunulmaktadır.
Elevidys FDA Tarafından Nasıl Onaylandı
Delandistrogene moxeparvovec-rokl'un (Elevidys) Duchenne kas distrofisi (DMD) için gen değiştirme tedavisi olarak iki Faz 3 randomize klinik çalışması 29 Ekim 2024'te Nature Medicine'de bildirildi.1Söz konusu rapora göre, bu ilacın klinik etkinliği iki nedenden dolayı kesin olarak kanıtlanmamıştır.
Her iki deneme de klinik fayda için birincil son noktalarına ulaşamadı. Klinik fayda, ayakta durma, yürüme, zıplama ve baş kaldırma dahil olmak üzere brüt motor performansının yörüngesini ölçen standart bir ölçek kullanılarak değerlendirildi.
İkinci olarak, marjinal olarak olumlu olan alternatif son noktalar (sonuçta Gıda ve İlaç Dairesi (FDA) tarafından onayı desteklemek için kullanıldı) istatistiksel testler yoluyla doğrulanamadı.
Ek olarak, birincil alternatif çıktı, yakın zamanda başka bir DMD gen terapisi denemesinde klinik açıdan anlamlılık göstermeyen bir biyobelirteç olan mikro-distrofin proteininin düzeyleriydi.2]
Elevidys Ne Zaman Onaylandı?
Sınırlı klinik kanıtlara rağmen, 22 Haziran 2023'te delandistrogene moxeparvovec-rokl, özellikle 4 ila 5 yaş arası ayakta tedavi gören çocuklarda Duchenne kas distrofisi (DMD) için ilk gen replasman tedavisi olarak FDA onayını aldı.3]
Onay, FDA'nin hızlandırılmış onay programı aracılığıyla alındı.4]
20 Haziran 2024'te FDA, hastalık teşhisi konmuş ve DMD geninde doğrulanmış bir mutasyona sahip 4 yaş ve üzeri ayakta tedavi gören bireyler için geleneksel yetkilendirmeyi kapsayacak şekilde onayını genişletti. Kurum ayrıca tekerlekli sandalyeye bağımlı 4 yaş ve üzeri bireyler için hızlandırılmış onay verdi. [5]
FDA'nin genişletilmiş onay eylemiyle ilgili klinik inceleme belgesinde endişe verici bir ifade kaydedildi: [6]
Biyolojik Değerlendirme ve Araştırma Merkezi (CBER) Müdürü Dr. Peter Marks, inceleme ekibinin tavsiyesini geçersiz kılarak başvuruyu onayladı.
Delandistrogene moxeparvovec-rokl artık Amerika Birleşik Devletleri'nde pazarlanmak üzere onaylandı. Terapi yakın zamanda kür başına $3 milyondan fazla fiyatlandırıldı. [7]
Duchenne Musküler Distrofi (DMD), etkili tedavi alternatiflerinin azlığı ile karakterize nadir, ilerleyici ve ölümcül bir rahatsızlıktır.
Duchenne Musküler Distrofi (DMD) mutasyonları öncelikle çekinik ve X bağlantılıdır ve erkeklerde baskın bir etkiye neden olur. Erkeklerde doğum sıklığı yaklaşık 3.600'de 1'dir. [Daha Fazlasını Okuyun: DMD Nedir?]
Bu mutasyonlar iskelet ve kalp kasının bozulmasına neden olur ve bu durum normal kas-iskelet gelişimine rağmen erken çocukluk döneminde ortaya çıkar. DMD genotipine sahip bireyler tipik olarak erken ergenlikte yürüme yeteneğini kaybeder ve genellikle otuzlu yaşlarında sona eren bir yaşam beklentisine sahiptir.
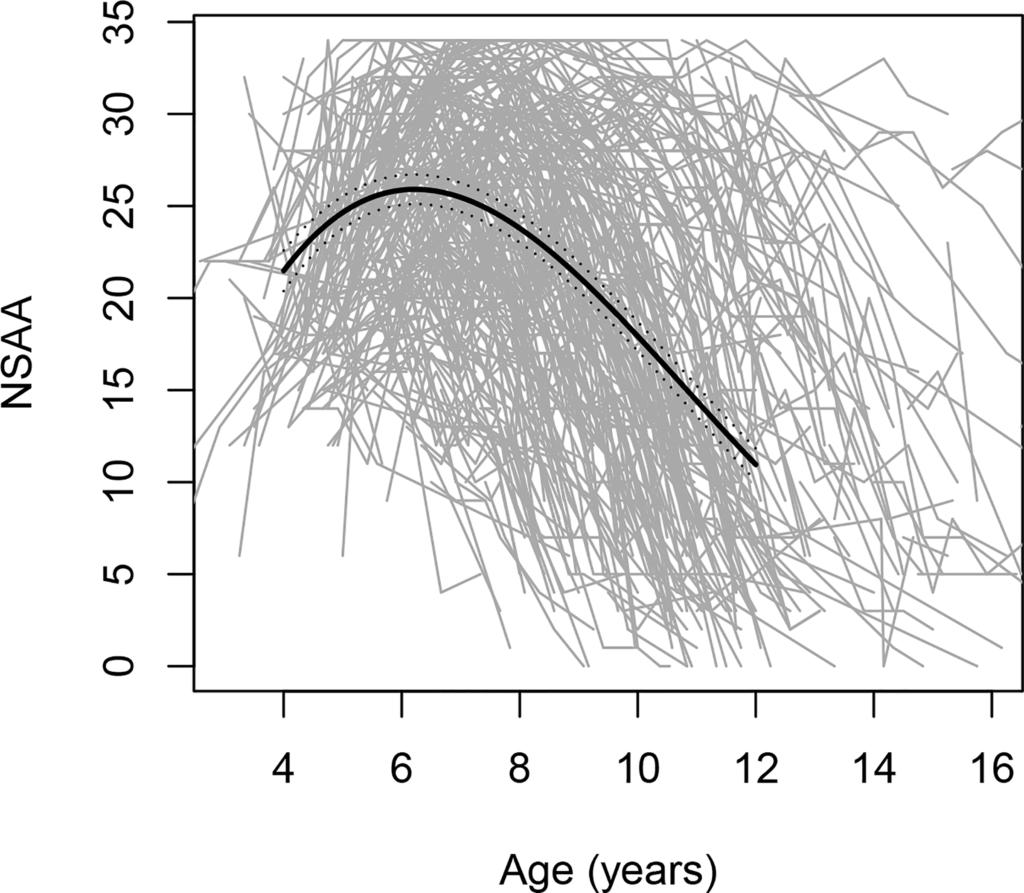
Hastalığın seyri heterojendir; bu durum, 4-16 yaş arası DMD'li erkek çocuklarda motor fonksiyon eğilimlerinde önemli değişkenlik olduğunu gösteren FDA verileriyle kanıtlanmıştır (Şekil'e bakın).
Figür. Brüt motor performans ölçeği olan North Star Ambulatuvar Değerlendirme (NSAA) puanlarındaki yaşa bağlı değişimler; her biri gri çizgiyle gösterilen 395 ayrı yörüngeyi içerir.
Sarepta'nın DMD Tedavileri
Delandistrogene moxeparvovec-rokl, Duchenne kas distrofisi (DMD) vakalarının çoğunluğu için ilk hastalık değiştirici tedaviyi temsil etmektedir; ancak, FDA daha önce DMD'nin daha az yaygın varyantları için dört ilacı onaylamıştı.
Eteplirsen (Exondys 51), gen-protein ekspresyonunda mutasyona uğramış bölgeleri atlayarak hedeflenen "ekzon atlamasını" mümkün kılan antisens oligonükleotidlerin kullanımı yoluyla belirli DMD mutasyonlarını ele almak üzere tasarlanmış, inceleme altındaki bir ilaçtır.8]
DMD için beş adet FDA onaylı tedavi yöntemi bulunmaktadır; bunların arasında delandistrogene moxeparvovec-rokl da vardır ve bunların hepsi, temel kas proteini distrofinin kesilmiş formlarını kullanır (aşağıda ayrıntılı olarak açıklanmıştır).9]
Tüm bu tedaviler FDA'nin hızlandırılmış onay programı aracılığıyla onay aldı. Hastalarda birkaç yıldır kullanılmasına rağmen, bu tedavilerin çoğu plaseboya göre önemli klinik avantajlar göstermedi.
Ayrıca, delandistrogene moxeparvovec-rokl'u da içeren dört kür, Sarepta Therapeutics adlı tek bir şirket tarafından üretilmektedir.10]
Hem eteplirsen hem de delandistrogene moxeparvovec-rokl'un onaylanması sırasında FDA komiseri olan Dr. Robert Califf, Sarepta'nın 2024'teki DMD ürünleriyle ilgili devam eden endişelerini dile getirerek, "Sarepta benim için bir lanet gibi." dedi.11]
Elevidys'in Etki Mekanizması
DMD'ye neden olan mutasyonlarda distrofin proteinini kodlayan genin ifadesi önemli ölçüde azalır veya susturulur.
Proteinin birçok biyokimyasal bileşeni kas hücrelerinin zarlarından geçer. Ek olarak, sık sık kasılma-genişleme döngülerinin neden olduğu potansiyel bozulmalara karşı kasları güçlü tutan bir şok emici görevi görür. [12]
Teorik olarak, DMD, distrofin ekspresyonunu bu hastalığa sahip olanların kas hücrelerinde teşvik ederek azaltılabilir veya hatta tersine çevrilebilir. Aktif bileşeni, "mikro-distrofin" olarak bilinen distrofinin kısaltılmış bir varyantını kodlayan modifiye edilmiş bir RNA dizisi olan delandistrogene moxeparvovec-rokl, bu kavrama yanıt olarak geliştirildi.
Mikrodistrofin, mutasyona uğramamış distrofinin yaklaşık 30% büyüklüğündedir. Hafif Becker tipi kas distrofisi olan hastalarda görülen kısalmış protein, delandistrogene moxeparvovec-rokl tarafından kodlanan mikro-distrofinin icadının temelini oluşturdu.
RNA dizisinin vücuda iletilebilmesi için viral kapsidlere bağlanması gerektiğinden, distrofin geninin kesilmesi gerekiyordu. Tam distrofin RNA'sı bu tür kapsidlerin kapasite sınırını aşmaktadır.
Delandistrogene moxeparvovec-rokl, vücuttaki distrofin fonksiyonunu en fazla kısmen geri kazandıracak bir proteinle sonuçlanan karmaşık bir biyomühendislik tekniği kullanılarak yaratıldı. Bu karmaşık tedavinin etkinliği henüz klinik çalışmalarda gösterilmemiştir.
2023 Hızlandırılmış Onayı
DMD'li 41 ayakta tedavi gören çocuk, yaşları 4 ila 7 arasında değişen, delandistrogene moxeparvovec-rokl'un ilk onayı için yapılan pivotal çalışmaya katıldı. İlaç veya plasebo almak üzere 1:1 oranında randomize edildiler.
Önceden belirlenmiş ana klinik sonuç, 17 maddelik standart bir ölçekle ölçülen 48 aylık bir süre boyunca brüt motor performansındaki değişiklikti; delandistrogene moxeparvovec-rokl ile tedavi edilen hastaların performansları kontrol grubuna kıyasla önemli ölçüde artmadı.13]
Gen tedavisi küründen 12 hafta sonra kas dokusunda mikro-distrofin ekspresyonunun vekil sonlanım noktasına dayanarak, sponsor Sarepta, olumsuz klinik çalışma sonuçları nedeniyle hızlı onay talep etti.
Mikrodistrofin ekspresyonunun 12. haftada kaydedilmesine rağmen, mikrodistrofin seviyeleri ile ortaya çıkan kas fonksiyonu arasında bir korelasyon yoktu. Sonuç olarak, FDA bilimsel incelemecileri, delandistrogene moxeparvovec-rokl denemesinden DMD'yi tedavi etmenin terapötik bir faydası olmadığı sonucuna vardılar. 2023'teki FDA klinik incelemesine göre: [14]
Bu nedenle, DMD geninde doğrulanmış bir DMD mutasyonu bulunan 4-5 yaşlarındaki ayakta tedavi gören DMD hastaları gibi küçük bir popülasyon için bile, bu veriler ELEVIDYS mikro-distrofininin, ELEVIDYS'in Hızlandırılmış Onayı için "klinik faydayı tahmin etme olasılığı makul" olan bir vekil son nokta olarak ifade edilmesini desteklemek için yetersizdir.
FDA Biyolojik Değerlendirme ve Araştırma Merkezi direktörü, kurumun bilimsel incelemecilerini dikkate almadı ve bu sert eleştirilere rağmen, ayakta tedavi gören 4 ve 5 yaşındaki DMD'li çocuklarda hızlı onay verme kararı aldı.
Karara göre, 41 hastanın 8'inden alınan veriler birincil dayanak olarak kullanıldı. Ek olarak, sponsorun "hızlandırılmış onayın bir koşulu olarak" sonuçları 2023 sonbaharında beklenen ikinci bir randomize denemeyi bitirmesi gerekiyordu. [15]
2024'te Genişletilmiş Onay
Sarepta, 30 Ekim 2023 tarihli bir basın bülteninde, delandistrogene moxeparvovec-rokl'un ikinci önemli randomize çalışmasının birincil sonlanım noktasına ulaşılamadığını söyledi.
Plasebo kontrollü bu çalışmada, 4 ila 7 yaş arasındaki 125 hasta, plasebo veya delandistrogene moxeparvovec-rokl almak üzere 1:1 oranında rastgele atandı.16]
Önceki deneyde kullanılan aynı kas fonksiyonu ölçeği puanındaki 52 haftalık değişim ana son noktaydı. İlaç ve plasebo arasında standartlaştırılmış brüt motor fonksiyonel ölçeğinde (maksimum aralığı 34 puan olan) sadece 0,65 puanlık bir ortalama fark bulundu, bu da sonuçları anlamlı kılmadı (p=0,25).
FDA, delandistrogene moxeparvovec-rokl'u orada onaylamayı bırakmalıydı. Üretici, 2023 onayına ek olarak, "güçlü, istatistiksel olarak anlamlı sonuçlar ürettiğini" söyledikleri ikincil sonuçları vurguladı... [ki] bir etkinlik takviyesini destekliyor.
FDA bilimsel incelemecileri bu yeni bulguları sert bir şekilde reddetti. Özellikle, 10 metrelik yürüme/koşu testleri ve yerden kalkmak için geçen süre iki önemli ikincil sonuçtu.
Delandistrogene moxeparvovec-rokl denekleri bu aktiviteleri, başlangıçta sırasıyla 3,5 ve 4,9 saniye süren plasebo deneklerinden ortalama 0,5 saniye daha hızlı gerçekleştirdiler.
FDA değerlendiricilerine göre, ne önceden belirlenmiş ne de çoklu veri analizleri için istatistiksel olarak düzeltilmiş olan bu bulgular "ELEVIDYS'in etkililiğini destekleyemez."
FDA değerlendiricilerine göre veriler aynı zamanda “yanıltıcıydı ve hastalar, aile üyeleri, bakıcılar ve reçete yazanlar dahil hiçbir paydaşın ELEVIDYS ile tedavinin potansiyel faydaları hakkında bilinçli kararlar almasına rehberlik edemezdi.” [17]
Ancak Haziran 2024'te CBER Direktörü ekibinin kararını bozdu ve FDA bilim insanlarının olumsuz eleştirilerine rağmen delandistrogene moxeparvovec-rokl'u ikinci kez onayladı.18]
Daha önce belirtildiği gibi, ikinci onay, 4 yaş ve üzeri olan ve DMD geninde doğrulanmış bir mutasyona sahip olan ayakta tedavi gören hastalarda tipik onayı içerecek şekilde izni genişletti ve güçlendirdi. Ek olarak, 4 yaş ve üzeri tekerlekli sandalyeye bağımlı kişiler için hızlandırılmış izin ikinci onaya dahil edildi. [19]
Mikrodistrofin protein seviyeleri ile yerde yatış pozisyonundan ayağa kalkma süresi verileri arasındaki bağlantıya dair vekil gösterge, CBER Direktörü'nün 2024 karar yazısında önemli bir etkendi.
Ancak bu bağlantı, kasın mikro-distrofin seviyesindeki her yüzdelik değişim için -0,012 saniyelik sığ eğim nedeniyle ne görsel (grafiksel) olarak ikna edici ne de istatistiksel olarak anlamlıydı (p=0,1388).
Ayrıca, çok sayıda veri noktasının tahmini regresyon çizgisinden önemli ölçüde saptığı görülmüştür.
İkinci pivotal denemedeki bireylerin sadece 25%'si bu analize dahil edildiğinden, FDA uzmanları mikro-distrofin doz-tepki verilerini değerlendirirken sonuçların "dikkatle yorumlanması" gerektiğini açıkça belirtmişlerdir. Sonuç olarak, DMD'yi tedavi etmek için mikro-distrofin gen eklemesinin kullanılmasına yönelik bilimsel gerekçelere rağmen, klinik çalışmalar gen terapisinin herhangi bir olumlu etkiye sahip olduğunu göstermemiştir. [20]
Gerçekten de, Pfizer tarafından geliştirilen bir DMD gen terapisinin yakın zamandaki Faz 3 denemesinde DMD hastalarının kaslarında "önemli miktarlarda" mikro-distrofin ekspresyonu görüldü, ancak buna uygun bir klinik iyileşme olmadı. Raporlara göre, Pfizer tedavileri üzerinde çalışmayı bıraktı. [21]
Aile Yorumları
Benzer endişeler DMD'den doğrudan etkilenenler tarafından dile getirildi. Delandistrogene moxeparvovec-rokl'un güvenliği ve etkinliğiyle ilgili endişeler, bir ebeveynin Eylül 2024'te çocukları için terapiye başvurmamayı seçtiklerini yazmasına yol açtı.22]
Çevrimiçi bir videoda, farklı bir ebeveyn Sarepta'yı yetersiz ve yakında modası geçecek bir tedavi yarattığı için eleştirdi. Buna karşılık, videoyu barındıran bir ebeveyn destek grubu, Sarepta Therapeutics'nin gruba fon sağlamayı bırakmakla tehdit etmesinin ardından web sitesinden delandistrogene moxeparvovec-rokl video eleştirisini kaldırmakla suçlandı. [23]
Elevidys Klinik Çalışmalarla Karşılaştırıldığında Fiyatı Açısından Uygun Mu?
Klinik çalışmaların sonuçları göz önüne alındığında, Elevidys gen terapisi için 3 milyon dolarlık fiyat etiketi makul mü? [Daha Fazlasını Okuyun: Duchenne Musküler Distrofi: Tedavi ve Maliyet]
Elevidys kullanımı sonrası vücutta üretilen distrofin miktarı ve klinik çalışmalarda incelenen North Star Ambulatuvar Değerlendirme (NSAA) skorları göz önüne alındığında, bu tedavi yöntemi için 3 Milyon ABD Doları oldukça fahiş bir rakamdır.
Elevidys'nin geliştiricisi Sarepta'ya ve küresel pazarlama otoritesi Roche'a çağrımız: Bu ticari amaç için konulan yüksek fiyat derhal düşürülsün!
Daha fazla bilgi edin: Duchenne Musküler Distrofisi İçin Umut Veren Yeni Gen Terapileri
İlk Ölüm Duyurusu
18 Mart 2025'te Sarepta Therapeutics, Duchenne kas distrofisi için gen tedavisi olan Elevidys ile ilişkili ilk kaydedilen ölümün 16 yaşında bir erkek çocukta meydana geldiğini bildirdi.Devamını oku]
Sonuç
Bir merkez müdürü, ilacı değerlendirmekle görevli olan FDA'nin bilimsel ekibinin kararını reddetti ve FDA, delandistrogene moxeparvovec-rokl'u DMD için bir gen tedavisi olarak onayladı.
Delandistrogene moxeparvovec-rokl'un iki temel denemesi ana klinik hedeflerine ulaşamadı. Delandistrogene moxeparvovec-rokl uygulamasını kurtarmak için kullanılan göstergeler, ikincil son noktalar (örneğin, 10 metrelik yürüyüş/koşu testleri) ve mikro-distrofin seviyelerinin dolaylı vekil göstergesi, kendi başlarına sorunluydu.
Sonuç olarak, FDA liderliğinin, halkın pahalı ve fiziksel olarak zorlayıcı, etkisiz bir ilaca maruz kalmasını engellemeyen riskli bir emsal yarattığını düşünüyoruz. [24]
Daha fazla bilgi edin: Duchenne Kas Distrofisi Pazarı Büyüyor: Ancak Tüm Aileler Tedavilere Erişemiyor
FDA kararına tepki göstermenin bir yolu, zayıf onay kriterlerinin sorun olduğunu ve çözümün daha sıkı onay standartları ve pazarlama sonrası prosedürler olduğunu söylemektir.25]
Her ne kadar daha sıkı onay standartları ve pazarlama sonrası gerekliliklerin gerekli olduğu konusunda hemfikir olsak da, FDA'nin iç süreçleri, düzenleyici bir karara atanan kurum bilim insanlarının fikir birliği değerlendirmesini geçersiz kılacak şekilde, liderlik rollerindeki bireysel yetkililerin bunu çok daha zor hale getirecek şekilde değiştirilmelidir.
Califf'e göre, iki delandistrogene moxeparvovec-rokl onay kararı sırasında FDA Komiseri olan kişi, karara karşı çıkanların ciddi ve nadir görülen bozukluklar için tedavi geliştirmedeki zorluklar konusunda "klinik kanıtlara ilişkin çok basit bir görüşe" sahip olduğunu söylüyor.26]
Bu değerlendirmeye katılmıyoruz. FDA, delandistrogene moxeparvovec-rokl'un onaylanması sonucunda, yaygın veya yaygın olmayan hastalıklar için olsun, yeni ilaçlar için karar alma sürecini geliştirmelidir.
Daha fazla bilgi edin: DMD WarrioR'un Türkiye Temsilcisi Elevidys Gen Terapisi Hakkındaki Görüşlerini Paylaşıyor
Ayrılmadan önceki bir röportajda Califf, bu kararı tartışarak, bu kadar ciddi ve nadir görülen hastalıkları olan ailelerin anlaşılabilir bir şekilde herhangi bir umut özlemi içinde olduğunu ve siyasi bir atama olarak kariyer FDA çalışanlarının aldığı kararları bozmaya isteksiz olduğunu belirtti. Bu faktörler önemli olsa da, FDA'nin delandistrogene moxeparvovec-rokl'u onaylama kararını desteklemek için yeterli değiller. [27]



