Gıda ve İlaç Dairesi (FDA), perşembe günü ilaçları reddedilen şirketlere gönderdiği 200'den fazla mektubu yayımlayarak, ilaç inceleme sürecinin bazen gözden kaçan bir kısmına dikkat çekti. Bu ret mektuplarından biri, Sarepta Therapeutics tarafından üretilen ve ekzon 53 atlama tedavisi için geliştirilen Vyondys 53 (golodirsen) adlı ilaç için gönderilmişti.
Kurum, yalnızca ürünleri nihayetinde onaylanan ve çoğu yıllar içinde piyasaya sürülen üreticilere gönderilen mektuplara odaklandı. Tüm mektupları tek bir yerde toplayan kurum, bu faaliyetin şeffaflığı teşvik etmeye yönelik daha geniş kapsamlı bir çabanın parçası olduğunu iddia etti.
İçindekiler
Vyondys 53 Hakkında FDA Red Mektubunun Ayrıntıları
FDA, Duchenne kas distrofisi için ekzon 53 atlama tedavisi olan Vyondys 53 (golodirsen) için 2019 tarihli ret mektubunu yayınladı. FDA, tedaviyle sağlanan “kısaltılmış distrofin düzeylerindeki küçük artış” göz önüne alındığında, Vyondys 53'ün klinik faydasının muhtemelen “orantılı olarak küçük” olacağını belirtmiştir.
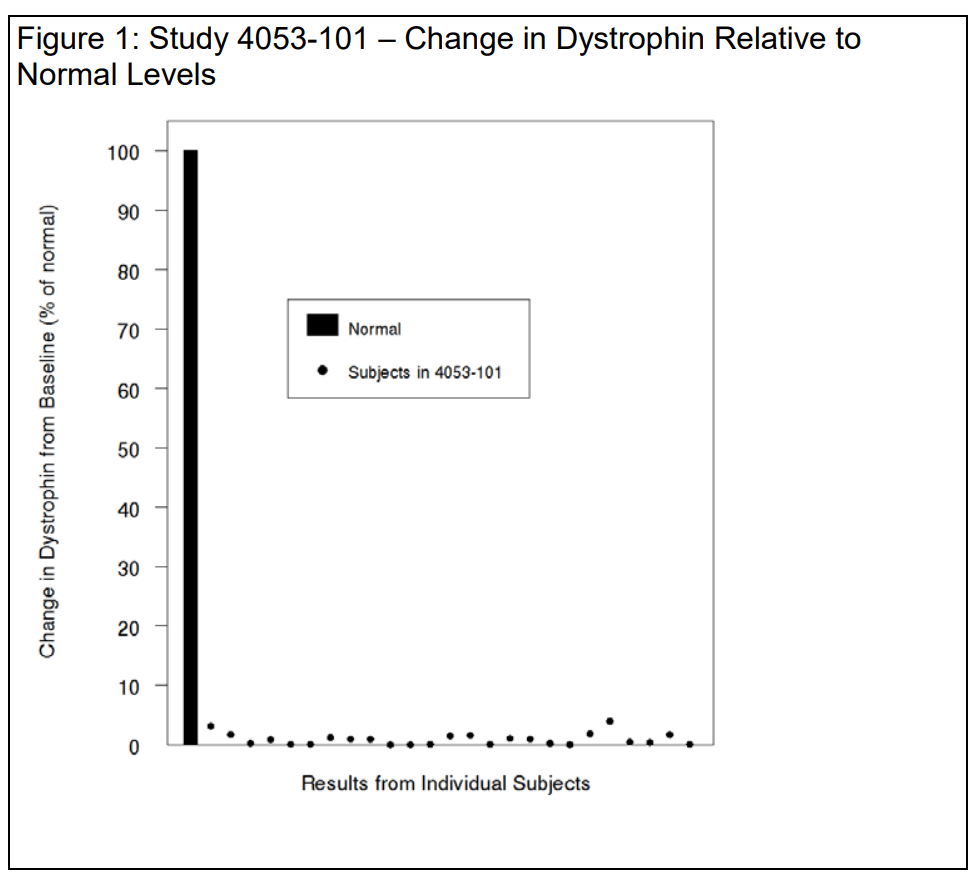
Distrofin seviyesi binde 9 oranında arttı
FDA'nın Vyondys 53 (golodirsen) için yazdığı ret mektubunda, ilacın kullanımından sonra distrofin seviyelerinde çok küçük bir artış olduğu belirtildi:
Çalışmada değerlendirilebilen 25 hasta için, Western blot ile değerlendirilen başlangıç ortalama distrofin seviyesi 0,10 ± 0,07 (normalin yüzdesi; ortalama ± SD) idi. 48. haftada, ortalama distrofin seviyesi 1,02 ± 1,03 (normalin yüzdesi; ortalama ± SD) idi ve bu, normalin ortalama %0,92 ± 1,01'lik bir artışına karşılık geliyordu.
Distrofindeki bireysel değişiklikler, verileri doğru bir perspektife oturtmak ve etki büyüklüğünün abartılmasını önlemek için aşağıdaki Şekil 1'de normal (100%) bir ölçek kullanılarak gösterilmiştir. Kesik distrofindeki ortalama artışların, sırasıyla ekson 53 ve ekson 51 atlamasına yatkın mutasyonları olan hastalarda golodirsen ve eteplirsen'e yanıt olarak benzer olduğunu fark ettiniz - mutlak ortalama artışlar 0,9%, yani binde 9. Biz de katılıyoruz.
Kesik distrofin düzeyinde binde 9 oranında küçük bir artışın klinik faydayı tahmin etme olasılığının makul olduğu kabul edilirse, klinik faydanın da buna orantılı olarak küçük olacağını varsaymak makul görünmektedir.
Vyondys 53'ün Klinik Etkisi
Çalışma 4053-101'deki 6 dakikalık yürüme verileri burada tartışılmamakla birlikte, esasen tüm erkek çocuklarda ilerleyici fiziksel işlev kaybı göstermektedir. Dahası, fiziksel performansın sürdürülmesi ile kesilmiş distrofin üretiminin büyüklüğü arasında bir korelasyon yoktur; bu da golodirsen'in gerçekten klinik bir etkisi varsa, etki boyutunun küçük olduğunu göstermektedir.
FDA'ye Göre Vyondys 53'ün Ciddi Yan Etkileri
Aralık 2019'da FDA, Sarepta'nın Vyondys 53'ünü, ekzon 53 atlamasına yatkın DMD hastaları için ilk hedefli tedavi seçeneği olarak onayladı. Ancak ilaç, dört ay önce, o dönemde İlaç Değerlendirme ve Araştırma Merkezi'nin İlaç Değerlendirme Ofisi başkanı olan Ellis Unger tarafından imzalanan bir CRL'de FDA tarafından reddedilmişti.
FDA, reddin gerekçesinde, tedavinin uyandırdığı "kesik distrofin düzeyindeki küçük artış" göz önüne alındığında, Vyondys 53'ün terapötik etkisinin muhtemelen "orantılı olarak küçük" olacağını belirtti. Unger, Vyondys 53'ün çocuklarda ürettiği distrofin miktarı ile fiziksel performansları arasında "bir ilişki" olmadığını ve ilacı aldıktan sonra muayene edilen çocukların "esas itibarıyla tamamında" artan fiziksel işlev kaybı görüldüğünü açıklayarak devam etti.
Sanki çürükler yetmezmiş gibi, Unger, Vyondys 53 kullanıcılarının uğraşmak zorunda kaldığı uzun bir güvenlik endişeleri listesi sıraladı. Bunlar arasında "böbrek toksisitesi" ve "ilaç kullanımına bağlı ciddi enfeksiyonlar" da vardı. Her ikisinin de "ölümcül olma potansiyeline sahip" olduğunu, ikincisinin ise "izlenmesinin zor veya imkansız" olduğunu iddia ediyor.
Sarepta'nın Elevidys gen terapisiyle bağlantılı ciddi karaciğer yetmezliğinden kaynaklanan iki ölüm göz önüne alındığında, bu ikinci uyarı özellikle endişe verici. Unger'in mektupta belirttiği gibi, Vyondys 53, Elevidys gibi adeno-ilişkili virüs (AAV) tabanlı bir gen terapisinin aksine, bir antisens oligonükleotid (ASO) olmasına rağmen, her iki tedavi yöntemi de karaciğer hasarıyla ilişkilendirilmiştir.
Devamını oku: Vyondys 53 FDA Reddetme Mektubu
Vyondys 53 Nasıl Onaylandı?
Düzenleyici kurumun CRL'de dile getirdiği endişeleri gidermek için Sarepta daha sonra itirazda bulundu ve FDA ile görüştü. Bu görüşme, o dönemde FDA'nin Yeni İlaçlar Ofisi başkanı olan Peter Stein'ın Nisan ayında kurumdan ayrılmasıyla sonuçlandı ve Vyondys 53 onaylandı.
İlaç Şirketleri Tüm Bilgileri Yayınlamıyor
"İlaç geliştiricileri, FDA'de gezinirken çok uzun zamandır tahmin oyunu oynuyorlar," dedi FDA Komiseri Dr. Marty Makary, MPH. "Hem ilaç geliştiricileri hem de sermaye piyasaları öngörülebilirlik istiyor. Bu yüzden bugün, hastalara daha hızlı tedavi ve anlamlı tedaviler sunma nihai hedefimizle, bunu onlara sunmaya bir adım daha yaklaştık."
FDA, bekleyen başvurular için CRL yayınlamaktan tarihsel olarak kaçındığı için, sponsorlar genellikle FDA'nin kararının gerekçesini paydaşlarına ve kamuoyuna yanlış aktarmaktadır. FDA araştırmacıları tarafından 2015 yılında yapılan bir analize göre, sponsorlar başvurularının onaylanmadığını kamuoyuna duyururken FDA'nin güvenlik ve etkililik konusundaki endişelerinden 85%'ye değinmekten kaçınmıştır. Dahası, FDA güvenlik veya etkililik için yeni bir klinik çalışma talep ettiğinde, bu kritik bilgi yaklaşık 40% zamanında açıklanmamaktadır. Onaylanmayan başvurulardan alınan dersler de sektörle paylaşılmamakta ve bu da şirketlerin benzer hataları tekrar tekrar yapmasına yol açmaktadır. – Devamını Oku: FDA, Eksiksiz Yanıt Mektupları Yayınlayarak Radikal Şeffaflığı Benimsiyor –