ELEVIDYS (डेलांडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल) जीन थेरेपी, जिसे दवा बाजार में पेश किया गया है, 3 मिलियन अमेरिकी डॉलर की लागत के संबंध में कितनी प्रभावी है? Elevidys जीन थेरेपी के नैदानिक परीक्षणों की समीक्षा इस निबंध का मुख्य विषय होगा। हम इस जीन थेरेपी की लागत और प्रभावशीलता का आकलन करेंगे, जिसे ड्यूचेन मस्कुलर डिस्ट्रॉफी के इलाज के लिए विकसित किया गया था। क्या क्लिनिकल परीक्षणों की तुलना में Elevidys की लागत उचित है?
विषयसूची
क्लिनिकल परीक्षणों का अवलोकन
खाद्य एवं औषधि प्रशासन (FDA) ने 2023 और 2024 में दुर्लभ लेकिन घातक बाल्यावस्था में होने वाली बीमारी ड्यूशेन मस्कुलर डिस्ट्रॉफी के लिए क्रांतिकारी जीन थेरेपी को अधिकृत किया है।
केवल 4-5 वर्ष की आयु के वे बच्चे जो चल सकते हैं (एम्बुलेंटरी) ही 2023 की अनुमति के लिए पात्र होंगे।
वर्ष 2024 के निर्णय ने इस मंजूरी को व्यापक बनाते हुए, 4 वर्ष या उससे अधिक आयु के डीएमडी जीन में सत्यापित उत्परिवर्तन वाले चल-फिर सकने वाले रोगियों के लिए भी पारंपरिक अनुमोदन को शामिल कर दिया।
इसके अतिरिक्त, FDA ने 4 वर्ष या उससे अधिक आयु के उन लोगों के लिए त्वरित अनुमोदन की स्थापना की जो व्हीलचेयर पर निर्भर हैं।
न तो अनुमोदन को उचित नैदानिक परीक्षण के परिणामों द्वारा समर्थित किया गया था, जो दिखाते थे कि डीएमडी वाले बच्चों में सकल मोटर क्षमता बरकरार रही या बहाल हुई, न ही सकारात्मक FDA वैज्ञानिक मूल्यांकन द्वारा।
FDA के निदेशक ने एजेंसी के वैज्ञानिक स्टाफ की उपेक्षा की, जिसके परिणामस्वरूप दोनों स्वीकृतियां प्राप्त हुईं।
इस पेपर में दो खराब तरीके से सोचे गए अनुमोदनों पर चर्चा की गई है, साथ ही उन कारणों पर भी चर्चा की गई है कि FDA नेताओं को भविष्य में अपने पैटर्न का पालन क्यों नहीं करना चाहिए। यह इस बारे में भी सुझाव देता है कि FDA विवादास्पद विनियामक निर्णयों को संभालने के तरीके को कैसे बदल सकता है।
Elevidys को FDA द्वारा कैसे अनुमोदित किया गया
ड्यूचेन मस्कुलर डिस्ट्रॉफी (डीएमडी) के लिए जीन प्रतिस्थापन इलाज के रूप में डेलैंडिस्ट्रोजीन मोक्सेपार्वोवेक-रोकल (1टीपी25टी) के दो चरण 3 यादृच्छिक नैदानिक परीक्षणों की रिपोर्ट 29 अक्टूबर, 2024 को नेचर मेडिसिन में दी गई थी।1उस रिपोर्ट के अनुसार, दो कारणों से इस दवा की नैदानिक प्रभावकारिता निर्णायक रूप से सिद्ध नहीं हुई है।
दोनों परीक्षणों ने नैदानिक लाभ के लिए अपने प्राथमिक समापन बिंदु हासिल नहीं किए। नैदानिक लाभ का मूल्यांकन एक मानकीकृत पैमाने का उपयोग करके किया गया था जो खड़े होने, चलने, कूदने और सिर उठाने सहित सकल मोटर प्रदर्शन के प्रक्षेपवक्र को मापता है।
दूसरे, वैकल्पिक समापन बिंदु जो मामूली रूप से अनुकूल थे - जिन्हें अंततः खाद्य एवं औषधि प्रशासन (FDA) द्वारा अनुमोदन के समर्थन में नियोजित किया गया था - को सांख्यिकीय परीक्षण के माध्यम से सत्यापित नहीं किया जा सका।
इसके अतिरिक्त, प्राथमिक वैकल्पिक परिणाम माइक्रो-डिस्ट्रोफिन प्रोटीन का स्तर था, एक बायोमार्कर जिसने हाल ही में एक अन्य डीएमडी जीन थेरेपी परीक्षण में नैदानिक प्रासंगिकता नहीं दिखाई। [2]
Elevidys को कब मंजूरी दी गई?
सीमित नैदानिक साक्ष्य के बावजूद, 22 जून 2023 को, डेलैंडिस्ट्रोजीन मोक्सेपार्वोवेक-रोकल को ड्यूचेन मस्कुलर डिस्ट्रॉफी (डीएमडी) के लिए पहली जीन प्रतिस्थापन चिकित्सा के रूप में FDA अनुमोदन प्राप्त हुआ, विशेष रूप से 4 से 5 वर्ष की आयु के चलने-फिरने में सक्षम बच्चों के लिए।3]
यह अनुमोदन FDA के त्वरित अनुमोदन कार्यक्रम के माध्यम से प्राप्त किया गया।4]
20 जून, 2024 को, FDA ने 4 वर्ष या उससे अधिक आयु के उन लोगों के लिए पारंपरिक प्राधिकरण को शामिल करने के लिए अपनी स्वीकृति को व्यापक बनाया, जो इस बीमारी से पीड़ित हैं और जिनके DMD जीन में पुष्टि की गई उत्परिवर्तन है। एजेंसी ने 4 वर्ष या उससे अधिक आयु के उन लोगों के लिए भी त्वरित स्वीकृति प्रदान की है, जो व्हीलचेयर पर निर्भर हैं। [5]
विस्तारित अनुमोदन कार्रवाई से संबंधित FDA के नैदानिक समीक्षा दस्तावेज़ में एक चिंताजनक बयान नोट किया गया था: [6]
सेंटर फॉर बायोलॉजिक्स इवैल्यूएशन एंड रिसर्च (सीबीईआर) के निदेशक डॉ. पीटर मार्क्स ने समीक्षा टीम की सिफारिश को खारिज करते हुए आवेदन को मंजूरी दे दी है।
डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल को अब संयुक्त राज्य अमेरिका में विपणन के लिए मंजूरी दे दी गई है। इस थेरेपी की कीमत हाल ही में प्रति इलाज $3 मिलियन से अधिक रखी गई है। [7]
ड्यूशेन मस्कुलर डिस्ट्रॉफी (डीएमडी) एक दुर्लभ, प्रगतिशील और घातक स्थिति है, जिसका प्रभावी उपचार विकल्पों की कमी है।
ड्यूचेन मस्कुलर डिस्ट्रॉफी (डीएमडी) उत्परिवर्तन मुख्य रूप से अप्रभावी और एक्स-लिंक्ड होते हैं, जिसके परिणामस्वरूप पुरुषों पर अधिक प्रभाव पड़ता है। पुरुषों में जन्म की घटना लगभग 3,600 में से 1 है। [और पढ़ें: डीएमडी क्या है?]
इन उत्परिवर्तनों के परिणामस्वरूप कंकाल और हृदय की मांसपेशियों का क्षरण होता है, जो सामान्य मस्कुलोस्केलेटल विकास के बावजूद, बचपन में ही प्रकट होता है। डीएमडी जीनोटाइप वाले व्यक्ति आमतौर पर किशोरावस्था की शुरुआत में ही चलने-फिरने में असमर्थ हो जाते हैं और उनकी जीवन प्रत्याशा अक्सर उनके तीसवें दशक में समाप्त हो जाती है।
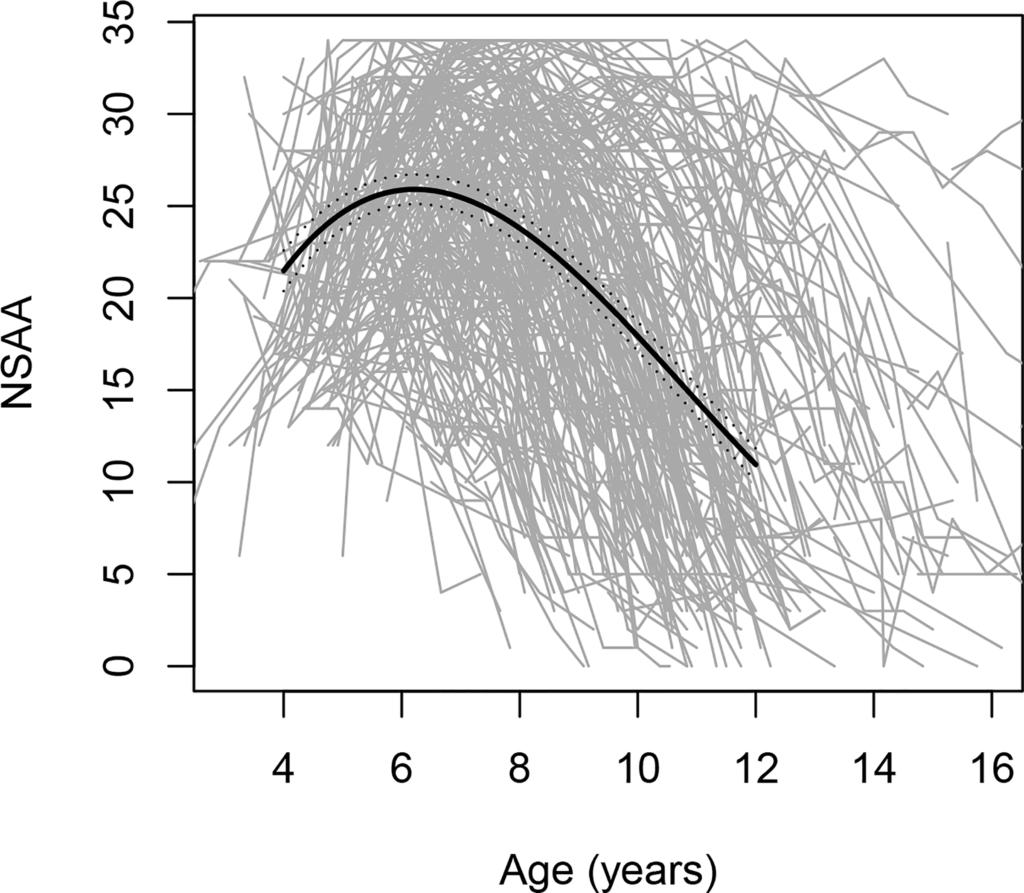
रोग का पाठ्यक्रम विषम है, जैसा कि FDA डेटा से पता चलता है, जो 4-16 वर्ष की आयु के डीएमडी वाले लड़कों के बीच मोटर फ़ंक्शन प्रवृत्तियों में महत्वपूर्ण परिवर्तनशीलता दर्शाता है (चित्र देखें).
आकृति। नॉर्थ स्टार एम्बुलेटरी असेसमेंट (NSAA) स्कोर में आयु के साथ परिवर्तन, जो एक सकल मोटर प्रदर्शन पैमाना है; इसमें 395 व्यक्तिगत प्रक्षेप पथ शामिल हैं, जिनमें से प्रत्येक को ग्रे लाइन द्वारा दर्शाया गया है।
सरेप्टा का डीएमडी उपचार
डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल, ड्यूचेन मस्कुलर डिस्ट्रॉफी (डीएमडी) के अधिकांश मामलों के लिए प्रारंभिक रोग-संशोधित चिकित्सा का प्रतिनिधित्व करता है; हालांकि, 1टीपी38टी ने पहले डीएमडी के कम सामान्य रूपों के लिए चार दवाओं को मंजूरी दी थी।
Eteplirsen (Exondys 51) एक जांच के तहत दवा है, जिसे एंटीसेन्स ऑलिगोन्युक्लियोटाइड्स के उपयोग के माध्यम से विशिष्ट डीएमडी उत्परिवर्तन को संबोधित करने के लिए डिज़ाइन किया गया है जो लक्षित "एक्सॉन स्किपिंग" को सक्षम करता है, जिससे जीन-टू-प्रोटीन अभिव्यक्ति में उत्परिवर्तित क्षेत्रों को बायपास किया जाता है।8]
डी.एम.डी. के लिए पांच 1टीपी38टी-स्वीकृत उपचार हैं, जिनमें डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल शामिल है, जिनमें से सभी आवश्यक मांसपेशी प्रोटीन डिस्ट्रोफिन के कटे हुए रूपों का उपयोग करते हैं (जैसा कि नीचे विस्तार से बताया गया है)। [9]
इन सभी उपचारों को FDA के त्वरित अनुमोदन कार्यक्रम के माध्यम से स्वीकृति मिली। कई वर्षों से रोगियों में उपयोग किए जाने के बावजूद, इनमें से अधिकांश उपचारों ने प्लेसबो पर महत्वपूर्ण नैदानिक लाभ नहीं दिखाए हैं।
इसके अतिरिक्त, डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल सहित चार दवाएँ एक ही कंपनी, Sarepta Therapeutics द्वारा निर्मित की जाती हैं।10]
एटेप्लिर्सन और डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल दोनों के अनुमोदन के दौरान FDA आयुक्त डॉ रॉबर्ट कैलिफ़ ने 2024 में सरप्टा के डीएमडी उत्पादों के बारे में चल रही चिंताओं को व्यक्त करते हुए कहा, "सरप्टा मेरे लिए एक अभिशाप की तरह है।"11]
Elevidys की कार्य प्रणाली
प्रोटीन डिस्ट्रोफिन को कोड करने वाले जीन की अभिव्यक्ति, डी.एम.डी. उत्पन्न करने वाले उत्परिवर्तनों में, महत्वपूर्ण रूप से कम हो जाती है या समाप्त हो जाती है।
प्रोटीन के कई जैव रासायनिक घटक मांसपेशी कोशिकाओं की झिल्लियों को पार करते हैं। इसके अतिरिक्त, यह एक शॉक अवशोषक के रूप में कार्य करता है, जो लगातार संकुचन-विस्तार चक्रों द्वारा लाए जाने वाले संभावित गिरावट के सामने मांसपेशियों को मजबूत रखता है। [12]
सैद्धांतिक रूप से, डी.एम.डी. को उन लोगों की मांसपेशियों की कोशिकाओं में डिस्ट्रोफिन अभिव्यक्ति को प्रोत्साहित करके कम किया जा सकता है या उलट भी किया जा सकता है, जिन्हें यह बीमारी है। डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल, जिसका सक्रिय घटक एक संशोधित आर.एन.ए. अनुक्रम है जो डिस्ट्रोफिन के एक छोटे रूप को एनकोड करता है जिसे "माइक्रो-डिस्ट्रोफिन" के रूप में जाना जाता है, इस धारणा के जवाब में विकसित किया गया था।
माइक्रो-डिस्ट्रोफिन, अपरिवर्तित डिस्ट्रोफिन के आकार का लगभग 30% होता है। हल्के बेकर प्रकार के मांसपेशीय दुर्विकास वाले रोगियों में देखा गया छोटा प्रोटीन, डेलैंडिस्ट्रोजीन मोक्सेपार्वोवेक-रोकल द्वारा एनकोड किए गए माइक्रो-डिस्ट्रोफिन के आविष्कार का आधार बना।
चूँकि आरएनए अनुक्रम को वायरल कैप्सिड में बंडल करके शरीर में पहुँचाना पड़ता है, इसलिए डिस्ट्रोफ़िन जीन को काटना पड़ता है। पूर्ण डिस्ट्रोफ़िन आरएनए ऐसे कैप्सिड की क्षमता सीमा को पार कर जाता है।
डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल को एक जटिल बायोइंजीनियरिंग तकनीक का उपयोग करके बनाया गया था, जिसके परिणामस्वरूप एक प्रोटीन होता है जो पूरे शरीर में डायस्ट्रोफिन फ़ंक्शन को केवल आंशिक रूप से बहाल करेगा। इस जटिल चिकित्सा की प्रभावशीलता अभी तक नैदानिक परीक्षणों में नहीं दिखाई गई है।
2023 की त्वरित स्वीकृति
डी.एम.डी. से पीड़ित 4 से 7 वर्ष की आयु के 41 चलने-फिरने में सक्षम बच्चों ने डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल की पहली स्वीकृति के लिए निर्णायक परीक्षण में भाग लिया। उन्हें दवा या प्लेसीबो देने के लिए 1:1 अनुपात में यादृच्छिक किया गया।
मुख्य पूर्वनिर्धारित नैदानिक परिणाम 48 महीने की अवधि में सकल मोटर प्रदर्शन में परिवर्तन था, जैसा कि 17-आइटम मानकीकृत पैमाने द्वारा मापा गया था; डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल के साथ इलाज किए गए रोगियों ने नियंत्रण समूह की तुलना में अपने प्रदर्शन में उल्लेखनीय वृद्धि नहीं की।13]
जीन थेरेपी उपचार के 12 सप्ताह बाद मांसपेशियों के ऊतकों में माइक्रो-डिस्ट्रोफिन अभिव्यक्ति के सरोगेट समापन बिंदु के आधार पर, प्रायोजक, सरेप्टा ने प्रतिकूल नैदानिक परीक्षण परिणाम के कारण शीघ्र अनुमोदन का अनुरोध किया।
इस तथ्य के बावजूद कि 12 सप्ताह में माइक्रोडिस्ट्रोफ़िन अभिव्यक्ति देखी गई थी, माइक्रोडिस्ट्रोफ़िन के स्तर और आगामी मांसपेशी कार्य के बीच कोई संबंध नहीं था। नतीजतन, FDA वैज्ञानिक समीक्षक इस निष्कर्ष पर पहुंचे कि डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल परीक्षण से DMD के उपचार में कोई चिकित्सीय लाभ नहीं था। 2023 से FDA नैदानिक समीक्षा के अनुसार: [14]
इसलिए, एक छोटी आबादी के लिए भी, जैसे कि 4 से 5 वर्ष की आयु के डीएमडी से पीड़ित चलने-फिरने में सक्षम मरीज़ जिनके डीएमडी जीन में डीएमडी उत्परिवर्तन की पुष्टि हो चुकी है, ये आंकड़े एलिविडिएस माइक्रो-डिस्ट्रोफिन की अभिव्यक्ति को एलिविडिएस के त्वरित अनुमोदन के लिए "नैदानिक लाभ की भविष्यवाणी करने की उचित संभावना" के रूप में समर्थन देने के लिए अपर्याप्त हैं।
FDA के बायोलॉजिक्स मूल्यांकन एवं अनुसंधान निदेशक ने एजेंसी के वैज्ञानिक समीक्षकों की अनदेखी की तथा इस कठोर आलोचना के बावजूद DMD से पीड़ित 4 और 5 वर्ष के चलने-फिरने में सक्षम बच्चों को शीघ्र स्वीकृति देने का निर्णय लिया।
41 में से 8 मरीजों के डेटा ने निर्णय के लिए प्राथमिक आधार के रूप में काम किया। इसके अतिरिक्त, प्रायोजक को "त्वरित अनुमोदन की शर्त के रूप में" दूसरा यादृच्छिक परीक्षण पूरा करना आवश्यक था, जिसके परिणाम 2023 की शरद ऋतु तक आने की उम्मीद थी, निर्णय के अनुसार। [15]
2024 में विस्तारित स्वीकृति
सारेप्टा ने 30 अक्टूबर, 2023 की एक समाचार विज्ञप्ति में कहा कि डेलैंडिस्ट्रोजीन मोक्सेपार्वोवेक-रोकल के दूसरे निर्णायक यादृच्छिक परीक्षण का प्राथमिक समापन बिंदु पूरा नहीं हुआ।
उस प्लेसबो-नियंत्रित अध्ययन में, 4 से 7 वर्ष की आयु के 125 रोगियों को यादृच्छिक रूप से 1:1 अनुपात में प्लेसबो या डेलैंडिस्ट्रोजीन मोक्सेपार्वोवेक-रोकल दिया गया।16]
पिछले प्रयोग में इस्तेमाल किए गए उसी मांसपेशीय कार्य पैमाने के स्कोर पर 52-सप्ताह का परिवर्तन मुख्य समापन बिंदु था। मानकीकृत सकल मोटर कार्यात्मक पैमाने (जिसकी अधिकतम सीमा 34 अंक है) पर दवा और प्लेसबो के बीच केवल 0.65-बिंदु औसत अंतर पाया गया, जिससे परिणाम महत्वपूर्ण नहीं रहे (पी=0.25)।
FDA को डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल को मंजूरी देना बंद कर देना चाहिए था। 2023 की मंजूरी के लिए, निर्माता ने इसके बजाय माध्यमिक परिणामों पर जोर दिया, जिसके बारे में उन्होंने कहा कि इससे "मजबूत, सांख्यिकीय रूप से महत्वपूर्ण परिणाम मिले...[जो] एक प्रभावकारिता पूरक का समर्थन करते हैं।"
FDA के वैज्ञानिक समीक्षकों ने इस नए निष्कर्ष को बहुत ही कठोरता से खारिज कर दिया। विशेष रूप से, 10 मीटर चलने/दौड़ने के परीक्षण और फर्श की स्थिति से उठने में लगने वाला समय दो महत्वपूर्ण माध्यमिक परिणाम थे।
डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल विषयों ने इन गतिविधियों पर प्लेसबो विषयों की तुलना में औसतन 0.5 सेकंड अधिक तेजी से प्रदर्शन किया, जिन्होंने आधार रेखा पर क्रमशः 3.5 और 4.9 सेकंड का समय लिया।
FDA समीक्षकों के अनुसार, ये निष्कर्ष, जो न तो पूर्वनिर्धारित थे और न ही कई डेटा विश्लेषणों के लिए सांख्यिकीय रूप से सही थे, "ELEVIDYS की प्रभावशीलता का समर्थन नहीं कर सकते हैं"।
FDA समीक्षकों के अनुसार, डेटा भी "भ्रामक था और किसी भी हितधारक को मार्गदर्शन नहीं दे सकता - जिसमें मरीज, परिवार के सदस्य और देखभाल करने वाले, और प्रिस्क्राइबर शामिल हैं - ELEVIDYS के साथ इलाज के संभावित लाभों के बारे में सूचित निर्णय लेने में।"17]
हालाँकि, जून 2024 में, CBER निदेशक ने अपनी टीम को खारिज कर दिया और FDA वैज्ञानिकों की प्रतिकूल समीक्षाओं के बावजूद, दूसरी बार डेलैंडिस्ट्रोजीन मोक्सेपार्वोवेक-रोकल को मंजूरी दे दी। [18]
जैसा कि पहले बताया गया था, दूसरे अनुमोदन ने इस स्थिति से पीड़ित 4 वर्ष या उससे अधिक आयु के चलने-फिरने में सक्षम रोगियों में सामान्य अनुमोदन को शामिल करने के लिए अनुमति को विस्तारित और मजबूत किया है, जिनके DMD जीन में सत्यापित उत्परिवर्तन है। इसके अतिरिक्त, 4 वर्ष या उससे अधिक आयु के व्हीलचेयर पर निर्भर लोगों के लिए त्वरित अनुमति को दूसरे अनुमोदन में शामिल किया गया था। [19]
माइक्रो-डिस्ट्रोफिन प्रोटीन के स्तर और फर्श पर लेटने से उठने में लगने वाले समय के बीच संबंध का संकेत, CBER निदेशक के 2024 के निर्णय ज्ञापन में एक प्रमुख कारक था।
हालांकि, यह संबंध उथले ढलान (मांसपेशियों के माइक्रो-डिस्ट्रोफिन स्तर में प्रत्येक प्रतिशत परिवर्तन के लिए -0.012 सेकंड) के कारण न तो दृश्यात्मक रूप से (ग्राफिक रूप से) विश्वसनीय था और न ही सांख्यिकीय रूप से महत्वपूर्ण था (पी = 0.1388)।
इसके अलावा, बड़ी संख्या में डेटा बिंदु अनुमानित प्रतिगमन रेखा से काफी हद तक विचलित हो गए।
चूँकि दूसरे निर्णायक परीक्षण में सिर्फ़ 25% व्यक्तियों को इस विश्लेषण में शामिल किया गया था, इसलिए FDA विशेषज्ञों ने स्पष्ट रूप से नोट किया था कि माइक्रो-डिस्ट्रोफ़िन खुराक-प्रतिक्रिया डेटा का मूल्यांकन करते समय परिणामों की "सावधानी से व्याख्या" की जानी चाहिए। परिणामस्वरूप, DMD के उपचार के लिए माइक्रो-डिस्ट्रोफ़िन जीन सम्मिलन का उपयोग करने के वैज्ञानिक औचित्य के बावजूद, नैदानिक परीक्षणों ने यह नहीं दिखाया है कि जीन थेरेपी का कोई सकारात्मक प्रभाव है। [20]
दरअसल, फ़ाइज़र द्वारा विकसित डीएमडी जीन थेरेपी के हाल ही में चरण 3 के परीक्षण में डीएमडी रोगियों की मांसपेशियों में माइक्रो-डिस्ट्रोफ़िन अभिव्यक्ति की "काफ़ी मात्रा" देखी गई थी, लेकिन कोई समान नैदानिक सुधार नहीं हुआ। रिपोर्टों के अनुसार, फ़ाइज़र ने अपने इलाज पर काम करना बंद कर दिया है। [21]
परिवार टिप्पणियाँ
डीएमडी से सीधे प्रभावित होने वाले लोगों ने भी इसी तरह की चिंताएं व्यक्त की हैं। डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल की सुरक्षा और प्रभावकारिता के बारे में चिंताओं के कारण एक माता-पिता ने सितंबर 2024 में लिखा कि उन्होंने अपने बच्चे के लिए थेरेपी न लेने का फैसला किया है। [22]
एक ऑनलाइन वीडियो में, एक अलग अभिभावक ने सरेप्टा की आलोचना की कि उसने एक ऐसा इलाज बनाया है जो अपर्याप्त था और जल्द ही पुराना हो जाएगा। जवाब में, एक अभिभावक सहायता समूह जो वीडियो होस्ट कर रहा था, उस पर आरोप लगाया गया कि उसने अपनी वेबसाइट से डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल वीडियो-आलोचना को हटा दिया, क्योंकि Sarepta Therapeutics ने समूह को फंडिंग बंद करने की धमकी दी थी। [23]
क्या क्लिनिकल परीक्षणों की तुलना में Elevidys की लागत उचित है?
नैदानिक परीक्षणों के परिणामों को ध्यान में रखते हुए, क्या Elevidys जीन थेरेपी के लिए 3 मिलियन अमरीकी डॉलर का मूल्य उचित है? [अधिक पढ़ें: ड्यूचेन मस्कुलर डिस्ट्रॉफी: उपचार और लागत]
Elevidys के उपयोग के बाद शरीर में उत्पादित डिस्ट्रोफिन की मात्रा और नैदानिक परीक्षणों में जांचे गए नॉर्थ स्टार एम्बुलेटरी असेसमेंट (NSAA) स्कोर को ध्यान में रखते हुए, इस उपचार पद्धति के लिए 3 मिलियन अमरीकी डॉलर की राशि बहुत अधिक है।
Elevidys के डेवलपर, सरेप्टा, तथा वैश्विक विपणन प्राधिकरण, रोश से हमारा आह्वान: इस वाणिज्यिक उद्देश्य के लिए निर्धारित उच्च मूल्य को तुरंत कम करें!
और अधिक जानें: ड्यूचेन मस्कुलर डिस्ट्रॉफी के लिए संभावित आगामी नई जीन थेरेपी
पहली मृत्यु की घोषणा
18 मार्च, 2025 को, Sarepta Therapeutics ने कहा कि ड्यूचेन मस्कुलर डिस्ट्रॉफी, Elevidys के लिए उनके जीन थेरेपी से जुड़ी पहली दर्ज की गई मौत 16 वर्षीय लड़के में हुई थी।और पढ़ें]
निष्कर्ष
केंद्र के निदेशक ने FDA की वैज्ञानिक टीम के निर्णय को खारिज कर दिया, जिसे दवा का मूल्यांकन करने का काम सौंपा गया था, और FDA ने डी.एम.डी. के लिए जीन थेरेपी के रूप में डेलैंडिस्ट्रोजीन मोक्सेपार्वोवेक-रोकल को मंजूरी दे दी।
डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल के दो निर्णायक परीक्षण अपने मुख्य नैदानिक लक्ष्यों को पूरा करने में विफल रहे। डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल अनुप्रयोग को बचाने के लिए उपयोग किए जाने वाले संकेतक, जैसे कि द्वितीयक समापन बिंदु (उदाहरण के लिए, 10-मीटर वॉक/रन परीक्षण) और माइक्रो-डिस्ट्रोफिन स्तरों के अप्रत्यक्ष सरोगेट संकेतक, अपने आप में समस्याग्रस्त थे।
परिणामस्वरूप, हमारा मानना है कि FDA नेतृत्व ने एक जोखिमपूर्ण मिसाल कायम की है, जो जनता को एक अप्रभावी दवा के संपर्क में आने से नहीं बचाती, जो महंगी और शारीरिक रूप से कष्टदायक है। [24]
और अधिक जानें: ड्यूचेन मस्कुलर डिस्ट्रॉफी का बाजार बढ़ रहा है: लेकिन सभी परिवारों को उपचार तक पहुंच नहीं है
1टीपी38टी के फैसले पर प्रतिक्रिया करने का एक तरीका यह कहना है कि कमजोर अनुमोदन मानदंड समस्या है और सख्त अनुमोदन मानक और विपणन के बाद की प्रक्रियाएं ही इसका समाधान हैं।25]
FDA की आंतरिक प्रक्रियाओं में परिवर्तन किया जाना चाहिए, जिससे नेतृत्वकारी भूमिकाओं में बैठे व्यक्तिगत अधिकारियों के लिए नियामक निर्णय के लिए नियुक्त एजेंसी वैज्ञानिकों के सर्वसम्मति मूल्यांकन को दरकिनार करना अधिक कठिन हो जाए, भले ही हम इस बात पर सहमत हों कि सख्त अनुमोदन मानकों और विपणन-पश्चात आवश्यकताओं की आवश्यकता है।
कैलिफ़ के अनुसार, दो डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल अनुमोदन निर्णयों के समय FDA आयुक्त, जो लोग निर्णय का विरोध करते हैं, उनके पास गंभीर और असामान्य विकारों के लिए चिकित्सा विकसित करने में कठिनाइयों के बारे में "नैदानिक साक्ष्य का बहुत सरल दृष्टिकोण" है।26]
हम उस मूल्यांकन से सहमत नहीं हैं। डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल की स्वीकृति के परिणामस्वरूप FDA को नई दवाओं के लिए अपनी निर्णय लेने की प्रक्रिया को बढ़ाना चाहिए, चाहे वे सामान्य या असामान्य बीमारियों के लिए हों।
और अधिक जानें: डीएमडी वारियोआर के तुर्की प्रतिनिधि ने 1टीपी45टी जीन थेरेपी पर अपने विचार साझा किए
पद छोड़ने से पहले के एक साक्षात्कार में, कैलिफ़ ने इस निर्णय पर भी चर्चा की, जिसमें उन्होंने बताया कि ऐसी गंभीर और असामान्य बीमारियों से पीड़ित परिवार किसी भी उम्मीद के लिए तरस रहे थे, और एक राजनीतिक नियुक्त व्यक्ति के रूप में, वह कैरियर FDA कर्मचारियों द्वारा लिए गए निर्णयों को पलटने के लिए भी अनिच्छुक थे। हालाँकि ये कारक महत्वपूर्ण हैं, लेकिन वे डेलैंडिस्ट्रोजेन मोक्सेपार्वोवेक-रोकल को मंजूरी देने के FDA के निर्णय का समर्थन करने के लिए पर्याप्त नहीं हैं। [27]



