ما مدى فعالية العلاج الجيني ELEVIDYS (delandistrogene moxeparvovec-rokl)، الذي تم طرحه في سوق الأدوية، مقارنة بتكلفة 3 ملايين دولار أمريكي؟ ستكون مراجعة التجارب السريرية للعلاج الجيني Elevidys الموضوع الرئيسي لهذه المقالة. سنقيم تكلفة وفعالية هذا العلاج الجيني، الذي تم تطويره لعلاج ضمور العضلات دوشين. هل تكلفة Elevidys تستحق المقارنة بالتجارب السريرية؟
جدول المحتويات
نظرة عامة على التجارب السريرية
وافقت إدارة الغذاء والدواء (FDA) على علاج جيني ثوري في عامي 2023 و2024 لمرض ضمور العضلات دوشين النادر ولكن المميت الذي يصيب الأطفال.
كان فقط الشباب الذين تتراوح أعمارهم بين 4 و5 سنوات والذين يستطيعون المشي (المشي) مؤهلين للحصول على تصريح عام 2023.
وقد وسع الحكم الصادر في عام 2024 هذا الترخيص ليشمل الموافقة التقليدية للمرضى المتنقلين الذين يعانون من هذه الحالة وطفرة مؤكدة في جين دوشين والذين تبلغ أعمارهم 4 سنوات أو أكثر.
بالإضافة إلى ذلك، أنشأ FDA موافقة سريعة للأشخاص الذين تبلغ أعمارهم 4 سنوات أو أكثر والذين يعتمدون على الكراسي المتحركة.
ولم يتم دعم أي من الموافقتين بنتائج التجارب السريرية المناسبة التي تظهر أن الأطفال المصابين بمرض دوشين احتفظوا أو استعادوا القدرة الحركية الإجمالية، ولا بتقييمات علمية إيجابية لـ FDA.
لقد تجاهل مدير FDA الموظفين العلميين في الوكالة، مما أدى إلى الحصول على الموافقتين.
وتناقش هذه الورقة البحثية الموافقتين السيئتين إلى جانب الأسباب التي قد تمنع قادة FDA من اتباع نمطهم في المستقبل. كما تقدم الورقة البحثية اقتراحات حول كيفية تمكن FDA من تغيير الطريقة التي تتعامل بها مع القرارات التنظيمية المثيرة للجدال.
كيف تمت الموافقة على Elevidys بواسطة FDA
تم الإبلاغ عن التجربتين السريريتين العشوائيتين من المرحلة الثالثة لـ delandistrogene moxeparvovec-rokl (Elevidys) كعلاج بديل للجين لمرض ضمور العضلات دوشين (DMD) في مجلة Nature Medicine في 29 أكتوبر 2024. [1ولم يتم إثبات الفعالية السريرية لهذا الدواء بشكل قاطع لسببين، وفقاً لهذا التقرير.
لم تحقق كلتا التجربتين أهدافهما النهائية الأساسية فيما يتعلق بالفائدة السريرية. وتم تقييم الفائدة السريرية باستخدام مقياس موحد يقيس مسار الأداء الحركي الإجمالي، بما في ذلك الوقوف والمشي والقفز ورفع الرأس.
وثانياً، لم يكن من الممكن التحقق من نقاط النهاية البديلة التي كانت مواتية بشكل هامشي ــ والتي استخدمتها في نهاية المطاف إدارة الغذاء والدواء (FDA) لدعم الموافقة ــ من خلال الاختبارات الإحصائية.
بالإضافة إلى ذلك، كانت النتيجة البديلة الأساسية هي مستويات بروتين ميكروديستروفين، وهو مؤشر حيوي لم يظهر مؤخرًا أي أهمية سريرية في تجربة أخرى لعلاج جين دوشين. [2]
متى تمت الموافقة على Elevidys؟
على الرغم من الأدلة السريرية المحدودة، في 22 يونيو 2023، حصل delandistrogene moxeparvovec-rokl على موافقة FDA كأول علاج بديل للجينات لضمور العضلات دوشين (DMD)، وخاصة للأطفال القادرين على الحركة الذين تتراوح أعمارهم بين 4 إلى 5 سنوات. [3]
تم الحصول على الموافقة من خلال برنامج الموافقة السريعة FDA.4]
في 20 يونيو 2024، وسعت إدارة الغذاء والدواء الأمريكية (FDA) موافقتها لتشمل الترخيص التقليدي للأفراد القادرين على الحركة الذين تبلغ أعمارهم 4 سنوات أو أكثر والذين تم تشخيص إصابتهم بالمرض والذين لديهم طفرة مؤكدة في جين دوشين. كما منحت الوكالة موافقة سريعة للأفراد الذين تبلغ أعمارهم 4 سنوات أو أكثر والذين يعتمدون على الكراسي المتحركة.5]
وقد لوحظ بيان مثير للقلق في وثيقة المراجعة السريرية لـ FDA فيما يتعلق بإجراء الموافقة الموسعة: [6]
وافق الدكتور بيتر ماركس، مدير مركز تقييم المواد البيولوجية والبحث (CBER)، على الطلب من خلال إلغاء توصية فريق المراجعة.
تمت الموافقة الآن على تسويق عقار Delandistrogene moxeparvovec-rokl في الولايات المتحدة. وقد تم تسعير العلاج مؤخرًا بأكثر من $3 مليون دولار أمريكي لكل علاج. [7]
ضمور العضلات دوشين (DMD) هو حالة نادرة وتقدمية ومميتة تتميز بندرة البدائل العلاجية الفعالة.
إن طفرات ضمور العضلات دوشين (DMD) متنحية في المقام الأول ومرتبطة بالكروموسوم X، مما يؤدي إلى التأثير السائد على الذكور. يبلغ معدل حدوث الولادة عند الذكور حوالي 1 من كل 3600. [اقرأ المزيد: ما هو دوشين؟]
تؤدي هذه الطفرات إلى تدهور العضلات الهيكلية والقلبية، وهو ما يظهر في مرحلة الطفولة المبكرة، على الرغم من التطور العضلي الهيكلي الطبيعي. وعادة ما يفقد الأفراد المصابون بجين دوشين القدرة على المشي بحلول سن المراهقة المبكرة، وينتهي متوسط العمر المتوقع لديهم غالبًا في الثلاثينيات من العمر.
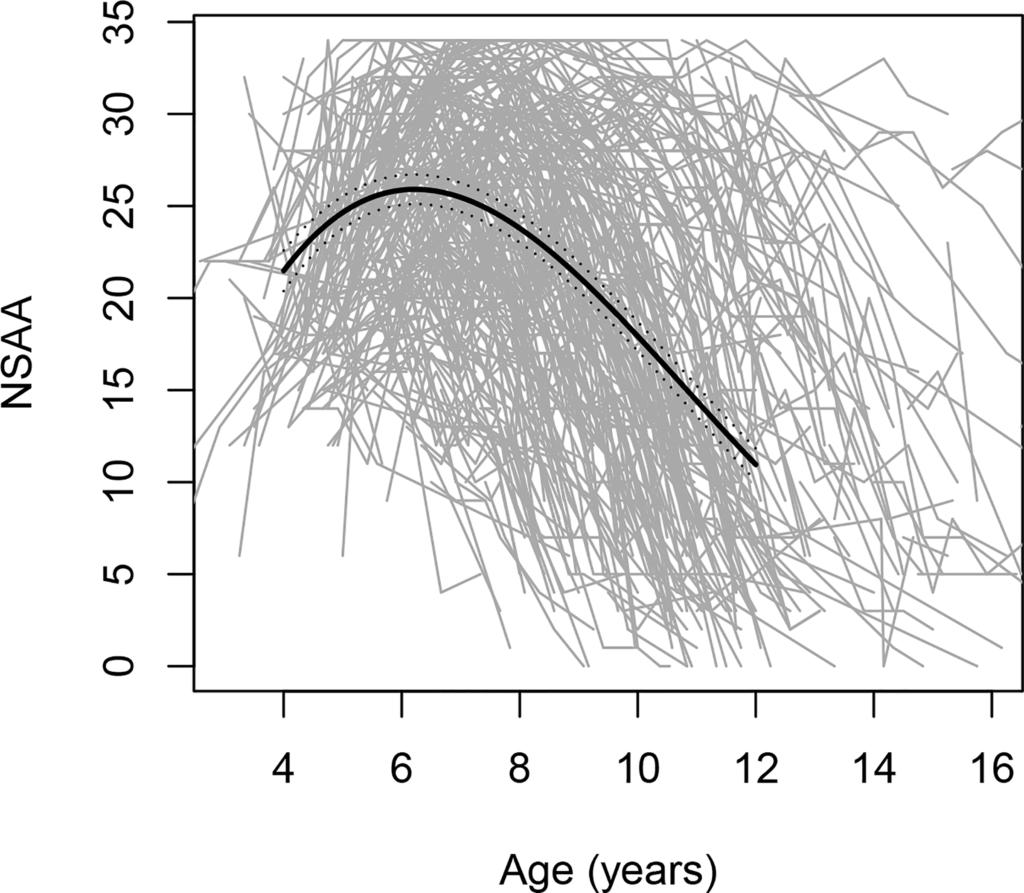
مسار المرض غير متجانس، كما يتضح من بيانات FDA التي تشير إلى تباين كبير في اتجاهات الوظيفة الحركية بين الأولاد المصابين بمرض دوشين الذين تتراوح أعمارهم بين 4 و16 عامًا (انظر الشكل).
شكل. التغيرات في درجات تقييم الحركة النجمية الشمالية (NSAA)، وهو مقياس للأداء الحركي الإجمالي، مع تقدم العمر؛ يتضمن 395 مسارًا فرديًا، يظهر كل منها بخط رمادي.
علاجات ساريبتا لمرض ضمور العضلات
يمثل Delandistrogene moxeparvovec-rokl العلاج الافتتاحي لتعديل المرض بالنسبة لغالبية حالات ضمور العضلات دوشين (DMD)؛ ومع ذلك، فقد وافقت FDA في وقت سابق على أربعة أدوية لمتغيرات أقل شيوعًا من DMD.
Eteplirsen (Exondys 51) هو دواء قيد التدقيق، مصمم لمعالجة طفرات DMD المحددة من خلال استخدام الأوليجونوكليوتيدات المضادة للاتجاه التي تمكن "تخطي الإكسون المستهدف"، وبالتالي تجاوز المناطق المتحولة في التعبير عن الجينات إلى البروتين.8]
هناك خمسة علاجات معتمدة من FDA لمرض دوشين، بما في ذلك delandistrogene moxeparvovec-rokl، والتي تستخدم جميعها أشكالًا مختصرة من بروتين العضلات الأساسي ديستروفين (كما هو مفصل أدناه). [9]
حصلت كل هذه العلاجات على الموافقة من خلال برنامج الموافقة السريع لـ FDA. وعلى الرغم من استخدامها مع المرضى لعدة سنوات، فإن غالبية هذه العلاجات لم تظهر مزايا سريرية كبيرة مقارنة بالعلاج الوهمي.
بالإضافة إلى ذلك، يتم إنتاج أربعة من العلاجات، بما في ذلك delandistrogene moxeparvovec-rokl، بواسطة شركة واحدة، Sarepta Therapeutics. [10]
أعرب الدكتور روبرت كاليف، مفوض FDA أثناء الموافقة على كل من eteplirsen وdelandistrogene moxeparvovec-rokl، عن مخاوفه المستمرة بشأن منتجات DMD الخاصة بشركة Sarepta في عام 2024، قائلاً: "إن Sarepta بمثابة لعنة بالنسبة لي".11]
آلية عمل Elevidys
يتم تقليل أو إسكات التعبير عن الجين الذي يشفر بروتين الديستروفين بشكل كبير في الطفرات التي تسبب مرض دوشين.
تعبر العديد من المكونات الكيميائية الحيوية للبروتين أغشية الخلايا العضلية. بالإضافة إلى ذلك، يعمل كممتص للصدمات، مما يحافظ على قوة العضلات في مواجهة التدهور المحتمل الناجم عن دورات الانكماش والتمدد المتكررة.12]
من الناحية النظرية، يمكن التخفيف من حدة مرض دوشين أو حتى عكس مساره من خلال تشجيع إفراز الديستروفين في الخلايا العضلية لدى المصابين به. وقد تم تطوير ديلاندستروجين موكسيبارفوفيك-روكل، الذي يتكون مكونه النشط من تسلسل RNA معدل يشفر نسخة مختصرة من الديستروفين المعروفة باسم "الميكرو ديستروفين"، استجابة لهذه الفكرة.
يبلغ حجم الميكروديستروفين حوالي 30% من حجم الديستروفين غير المتحور. كان البروتين المختصر الموجود في المرضى الذين يعانون من النوع الأخف من ضمور العضلات حسب تصنيف بيكر بمثابة الأساس لاختراع الميكرو ديستروفين المشفر بواسطة ديلاندستروجين موكسيبارفوفيك-روكل.
نظرًا لأن تسلسل الحمض النووي الريبوزي كان لابد من تجميعه في كبسولات فيروسية حتى يتم توصيله إلى الجسم، فقد كان لابد من قطع جين الديستروفين. يتجاوز الحمض النووي الريبوزي الكامل للديستروفين الحد الأقصى لقدرة مثل هذه الكبسولات.
تم إنشاء ديلاندستروجين موكسيبارفوفيك-روكل باستخدام تقنية هندسة حيوية معقدة تؤدي إلى بروتين يعمل على استعادة وظيفة الديستروفين في الجسم جزئيًا فقط. لم يتم إثبات فعالية هذا العلاج المعقد حتى الآن في التجارب السريرية.
الموافقة السريعة على عام 2023
شارك واحد وأربعون طفلاً متنقلاً مصابين بمرض دوشين تتراوح أعمارهم بين 4 و7 سنوات في التجربة المحورية للحصول على الموافقة الأولى على عقار ديلاندستروجين موكسيبارفوفيك-روكل. وتم توزيعهم عشوائياً بنسبة 1:1 لتلقي الدواء أو دواء وهمي.
كانت النتيجة السريرية الرئيسية المحددة مسبقًا هي التغيير في الأداء الحركي الإجمالي على مدى فترة 48 شهرًا كما تم قياسه بمقياس موحد مكون من 17 عنصرًا؛ لم يعزز المرضى الذين عولجوا بـ delandistrogene moxeparvovec-rokl أدائهم بشكل كبير مقارنة بمجموعة التحكم. [13]
وبناءً على نقطة النهاية البديلة لتعبير الميكروديستروفين في أنسجة العضلات بعد 12 أسبوعًا من علاج العلاج الجيني، طلبت شركة Sarepta، الراعية، موافقة سريعة بسبب النتيجة غير المواتية للتجربة السريرية.
على الرغم من ملاحظة التعبير عن الميكروديستروفين عند 12 أسبوعًا، لم يكن هناك ارتباط بين مستويات الميكروديستروفين ووظيفة العضلات الناتجة. وبالتالي، توصل المراجعون العلميون لـ FDA إلى استنتاج مفاده أنه لا توجد فائدة علاجية لعلاج دوشين من تجربة delandistrogene moxeparvovec-rokl. وفقًا للمراجعة السريرية لـ FDA من عام 2023: [14]
لذلك، حتى بالنسبة لعدد صغير من السكان، مثل المرضى المتنقلين المصابين بمرض دوشين الذين تتراوح أعمارهم بين 4 إلى 5 سنوات والذين لديهم طفرة دوشين مؤكدة في جين دوشين الخاص بهم، فإن هذه البيانات غير كافية لدعم التعبير عن ELEVIDYS micro-dystrophin كنقطة نهاية بديلة "من المرجح بشكل معقول أن تتنبأ بالفائدة السريرية" للموافقة السريعة على ELEVIDYS.
لقد تجاهل مدير مركز تقييم وأبحاث المواد البيولوجية التابع لـ FDA المراجعين العلميين للوكالة وقرر منح الموافقة السريعة للأطفال القادرين على الحركة الذين تتراوح أعمارهم بين 4 و5 سنوات والذين يعانون من دوشين على الرغم من هذا الانتقاد القاسي.
كانت البيانات المستمدة من 8 من أصل 41 مريضًا بمثابة الأساس الأساسي للقرار. بالإضافة إلى ذلك، كان الراعي "مطالبًا كشرط للموافقة السريعة" بإنهاء تجربة عشوائية ثانية، ومن المتوقع ظهور نتائجها بحلول خريف عام 2023، وفقًا للحكم. [15]
الموافقة الموسعة في عام 2024
قالت شركة ساريبتا في بيان صحفي بتاريخ 30 أكتوبر 2023، إن النقطة النهائية الأساسية للتجربة المحورية العشوائية الثانية للديلاندستروجين موكسيبارفوفيك-روكل لم يتم تحقيقها.
في تلك الدراسة التي تم التحكم فيها باستخدام الدواء الوهمي، تم توزيع 125 مريضًا تتراوح أعمارهم بين 4 و7 سنوات بشكل عشوائي بنسبة 1:1 لتلقي إما دواء وهمي أو ديلاندستروجين موكسيبارفوفيك-روكل. [16]
كان التغيير الذي حدث خلال 52 أسبوعًا على نفس درجة مقياس الوظائف العضلية المستخدمة في التجربة السابقة هو نقطة النهاية الرئيسية. ولم يتم العثور إلا على فرق متوسط قدره 0.65 نقطة بين الدواء والدواء الوهمي على مقياس الوظائف الحركية الإجمالية الموحد (الذي يبلغ نطاقه الأقصى 34 نقطة)، مما يجعل النتائج غير ذات دلالة إحصائية (p=0.25).
كان ينبغي لشركة FDA أن تتوقف عن الموافقة على عقار delandistrogene moxeparvovec-rokl في ذلك الوقت. وفي ما يتعلق بالموافقة في عام 2023، شددت الشركة المصنعة بدلاً من ذلك على النتائج الثانوية التي قالت إنها أنتجت "نتائج قوية وذات دلالة إحصائية... [تدعم] مكمل الفعالية".
لقد رفض المراجعون العلميون لـ FDA بشدة هذه النتائج الجديدة. وعلى وجه الخصوص، كانت اختبارات المشي/الجري لمسافة 10 أمتار والوقت الذي استغرقه النهوض من وضعية الأرض نتيجتين ثانويتين مهمتين.
أظهر المشاركون في هذه الأنشطة سرعة أكبر بمعدل 0.5 ثانية من المشاركين في العلاج الوهمي، الذين استغرقوا 3.5 و4.9 ثانية في البداية على التوالي.
هذه النتائج، التي لم يتم تحديدها مسبقًا أو تصحيحها إحصائيًا لتحليلات البيانات المتعددة، "لا يمكنها دعم فعالية ELEVIDYS"، وفقًا لمراجعي FDA.
وكانت البيانات، وفقًا لمراجعي FDA، "مضللة أيضًا ولا يمكنها توجيه أي من أصحاب المصلحة - بما في ذلك المرضى وأفراد الأسرة ومقدمي الرعاية والأطباء - في اتخاذ قرارات مستنيرة بشأن الفوائد المحتملة للعلاج باستخدام ELEVIDYS." [17]
ومع ذلك، في يونيو 2024، رفض مدير CBER فريقه ووافق على delandistrogene moxeparvovec-rokl للمرة الثانية، على الرغم من المراجعات غير المواتية من قبل علماء FDA. [18]
كما ذكرنا سابقًا، توسعت الموافقة الثانية وعززت الإذن ليشمل الموافقة النموذجية للمرضى المتنقلين المصابين بهذه الحالة والذين تبلغ أعمارهم 4 سنوات أو أكثر ولديهم طفرة مؤكدة في جين دوشين. بالإضافة إلى ذلك، تم دمج الإذن السريع للأشخاص المعتمدين على الكراسي المتحركة الذين تبلغ أعمارهم 4 سنوات وما فوق في الموافقة الثانية.19]
كان المؤشر البديل للارتباط بين مستويات بروتين ميكروديستروفين وبيانات الوقت المستغرق للنهوض من الاستلقاء على الأرض عاملاً رئيسيًا في مذكرة قرار مدير CBER لعام 2024.
ومع ذلك، لم يكن هذا الرابط مقنعًا بصريًا (بيانيًا) أو مهمًا إحصائيًا (ص = 0.1388) بسبب المنحدر الضحل (-0.012 ثانية لكل نسبة تغير في مستوى الديستروفين الدقيق في العضلة).
وعلاوة على ذلك، انحرف عدد كبير من نقاط البيانات بشكل كبير عن خط الانحدار المقدر.
ولأن 25% فقط من الأفراد في التجربة المحورية الثانية قد تم تضمينهم في هذا التحليل، فقد أشار خبراء FDA صراحة إلى أنه ينبغي "تفسير النتائج بحذر" عند تقييم بيانات استجابة جرعة الديستروفين الدقيقة. ونتيجة لهذا، وعلى الرغم من التبرير العلمي لاستخدام إدخال جين الديستروفين الدقيقة لعلاج دوشين، فإن التجارب السريرية لم تظهر أن العلاج الجيني له أي آثار إيجابية.20]
في الواقع، تم رصد "كميات كبيرة" من التعبير عن الميكرو ديستروفين في عضلات مرضى دوشين في تجربة أجريت مؤخرًا في المرحلة الثالثة لعلاج جيني لمرض دوشين طورته شركة فايزر، ولكن لم يكن هناك تحسن سريري متناسب. ووفقًا للتقارير، توقفت شركة فايزر عن العمل على علاجها. [21]
تعليقات العائلة
أعرب أولئك الذين تأثروا بشكل مباشر بمرض دوشين عن مخاوف مماثلة. أدت المخاوف بشأن سلامة وفعالية عقار ديلاندستروجين موكسيبارفوفيك-روكل إلى دفع أحد الوالدين إلى الكتابة في سبتمبر 2024 أنه اختار عدم متابعة العلاج لطفله.22]
في مقطع فيديو على الإنترنت، انتقد أحد الآباء شركة Sarepta لأنها ابتكرت علاجًا غير كافٍ وسيصبح قديمًا قريبًا. وردًا على ذلك، اتُهمت مجموعة دعم الآباء التي كانت تستضيف الفيديو بإزالة مقطع الفيديو النقدي لـ delandistrogene moxeparvovec-rokl من موقعها على الإنترنت بعد أن هددت Sarepta Therapeutics بوقف تمويل المجموعة.23]
هل تكلفة Elevidys تستحق المقارنة بالتجارب السريرية؟
بالنظر إلى نتائج التجارب السريرية، هل سعر 3 ملايين دولار أمريكي لعلاج الجين Elevidys معقول؟ [اقرأ المزيد: ضمور العضلات دوشين: العلاج والتكلفة]
إذا أخذنا في الاعتبار كمية الديستروفين التي يتم إنتاجها في الجسم بعد استخدام Elevidys ودرجات تقييم North Star Ambulatory Assessment (NSAA) التي تم فحصها في التجارب السريرية، فإن 3 ملايين دولار أمريكي مبلغ باهظ للغاية لهذه الطريقة العلاجية.
نداء إلى شركة Sarepta، المطورة لـ Elevidys، وشركة Roche، السلطة التسويقية العالمية: قم بتخفيض هذا السعر المرتفع المخصص لهذا الغرض التجاري على الفور!
يتعلم أكثر: علاجات جينية جديدة محتملة لمرض ضمور العضلات دوشين
إعلان الوفاة الأول
في 18 مارس 2025، أعلنت شركة Sarepta Therapeutics أن أول حالة وفاة مسجلة مرتبطة بعلاجها الجيني لمرض ضمور العضلات دوشين، Elevidys، حدثت لصبي يبلغ من العمر 16 عامًا.اقرأ المزيد]
خاتمة
وقد رفض مدير المركز الفريق العلمي التابع لـ FDA، والذي كان مكلفًا بتقييم الدواء، ووافق FDA على delandistrogene moxeparvovec-rokl كعلاج جيني لمرض دوشين.
فشلت التجربتان المحوريتان اللتان أجريتا على عقار ديلاندستروجين موكسيبارفوفيك-روكل في تحقيق أهدافهما السريرية الرئيسية. وكانت المؤشرات المستخدمة لإنقاذ تطبيق عقار ديلاندستروجين موكسيبارفوفيك-روكل، مثل نقاط النهاية الثانوية (على سبيل المثال، اختبارات المشي/الجري لمسافة 10 أمتار) والمؤشر البديل غير المباشر لمستويات ميكرو ديستروفين، تشكل مشكلة في حد ذاتها.
ونتيجة لذلك، نعتقد أن قيادة FDA خلقت سابقة محفوفة بالمخاطر لا تحمي الجمهور من التعرض لدواء غير فعال ومكلف ويتطلب مجهودا جسديا كبيرا. [24]
يتعلم أكثر: نمو سوق ضمور العضلات دوشين: لكن ليس كل الأسر لديها القدرة على الوصول إلى العلاجات
إن إحدى الطرق للرد على حكم FDA هي القول إن معايير الموافقة الضعيفة هي المشكلة وأن معايير الموافقة الأكثر صرامة وإجراءات ما بعد التسويق هي الحل.25]
ينبغي تغيير العمليات الداخلية في مشروع FDA لجعل من الصعب للغاية على المسؤولين الأفراد في الأدوار القيادية تجاوز التقييم الإجماعي لعلماء الوكالة المكلفين باتخاذ قرار تنظيمي، على الرغم من أننا نتفق على أن معايير الموافقة الأكثر صرامة ومتطلبات ما بعد التسويق مطلوبة.
وبحسب كاليف، مفوض FDA في وقت اتخاذ قراري الموافقة على عقار ديلاندستروجين موكسيبارفوفيك-روكل، فإن أولئك الذين يعارضون القرار لديهم "وجهة نظر مبسطة للغاية للأدلة السريرية" بشأن الصعوبات في تطوير علاجات للاضطرابات الخطيرة وغير الشائعة.26]
لا نتفق مع هذا التقييم. ينبغي للجنة FDA أن تعمل على تعزيز عملية اتخاذ القرار بشأن المستحضرات الصيدلانية الجديدة، سواء كانت مخصصة لأمراض شائعة أو غير شائعة، نتيجة للموافقة على عقار ديلاندستروجين موكسيبارفوفيك-روكل.
يتعلم أكثر: ممثل DMD WarrioR التركي يشارك آراءه حول العلاج الجيني Elevidys
في مقابلة أجريت معه قبل مغادرته، ناقش كاليف القرار أيضًا، مشيرًا إلى أن الأسر التي تعاني من مثل هذه الأمراض الشديدة والنادرة كانت تتوق إلى أي أمل، وأنه بصفته معينًا سياسيًا، كان أيضًا مترددًا في إلغاء القرارات التي اتخذها موظفو FDA. وفي حين أن هذه العوامل مهمة، إلا أنها ليست كافية لدعم قرار FDA بالموافقة على عقار ديلاندستروجين موكسيبارفوفيك-روكل.27]



