نشرت إدارة الغذاء والدواء أكثر من 200 رسالة أرسلتها إلى الشركات بعد رفض أدويتها يوم الخميس، مما لفت الانتباه إلى جزء يتم تجاهله أحيانًا في عملية مراجعة الأدوية. تم إرسال إحدى خطابات الرفض هذه لدواء Vyondys 53 (golodirsen)، وهو دواء تم تصنيعه بواسطة Sarepta Therapeutics وتم تطويره لعلاج تخطي الإكسون 53.
ركزت الوكالة فقط على الرسائل الموجهة إلى المصنّعين الذين تمت الموافقة على منتجاتهم في النهاية، والتي كان معظمها قد صدر بالفعل على مر السنين. وبجمع جميع الرسائل في مكان واحد، زعمت الوكالة أن هذا النشاط جزء من جهد أوسع لتعزيز الشفافية.
جدول المحتويات
تفاصيل خطاب الرفض FDA حول Vyondys 53
أصدرت FDA خطاب رفضها لعام 2019 لـ Vyondys 53 (golodirsen)، وهو علاج لتخطي الإكسون 53 لمرض ضمور العضلات دوشين. وذكرت دراسة FDA أنه نظراً "للزيادة الطفيفة في مستويات الديستروفين المختصر" التي يوفرها العلاج، فإن الفائدة السريرية لـ Vyondys 53 من المرجح أن تكون "صغيرة بشكل متناسب".
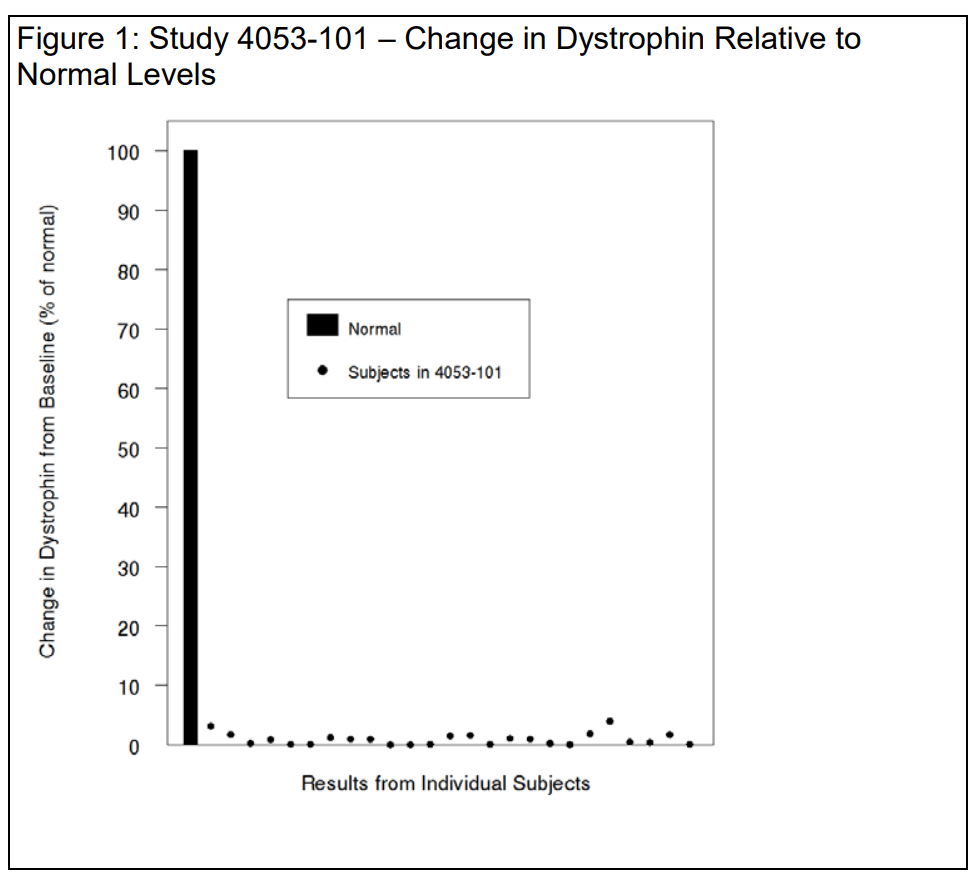
ارتفع مستوى الديستروفين بمقدار 9 أجزاء في الألف
أشارت رسالة رفض FDA لـ Vyondys 53 (golodirsen) إلى زيادة صغيرة جدًا في مستويات الديستروفين بعد استخدام الدواء:
بالنسبة للمرضى الخمسة والعشرين الذين خضعوا للتقييم في الدراسة، كان متوسط مستوى الديستروفين الأساسي، الذي تم تقييمه باستخدام اختبار ويسترن بلوت، 0.10 ± 0.07 (نسبة مئوية من المعدل الطبيعي؛ المتوسط ± الانحراف المعياري). في الأسبوع الثامن والأربعين، بلغ متوسط مستوى الديستروفين 1.02 ± 1.03 (نسبة مئوية من المعدل الطبيعي؛ المتوسط ± الانحراف المعياري)، ما يمثل زيادة متوسطة قدرها 0.92 ± 1.01% عن المعدل الطبيعي.
تظهر التغيرات الفردية في الديستروفين في الشكل 1 أدناه باستخدام مقياس طبيعي (100%) لوضع البيانات في منظورها الصحيح وتجنب المبالغة في حجم التأثير. لاحظتَ أن متوسط الزيادات في الديستروفين المقطوع متشابه في الاستجابة لدواءَي جولوديرسن وإيتيبليرسين لدى المرضى الذين لديهم طفرات قابلة لتخطي الإكسون 53 والإكسون 51، على التوالي - بمتوسط زيادات مطلقة قدره 0.9%، أي 9 أجزاء من الألف. نتفق معك.
إذا قبلنا الفرضية القائلة بأن الزيادة الطفيفة في الديستروفين المبتور، في حدود 9 أجزاء في الألف، من المرجح بشكل معقول أن تتنبأ بالفائدة السريرية، فمن المعقول أن نفترض أن الفائدة السريرية ستكون صغيرة بالتناسب.
التأثير السريري لـ Vyondys 53
لم تُناقش بيانات المشي لمدة 6 دقائق من الدراسة 4053-101 في هذه الدراسة، ولكنها تُظهر فقدانًا تدريجيًا للوظائف البدنية لدى جميع الأولاد تقريبًا. علاوة على ذلك، لا يوجد ارتباط بين الحفاظ على الأداء البدني وحجم إنتاج الديستروفين المقطوع، مما يشير إلى أنه إذا كان هناك بالفعل تأثير سريري لدواء غولوديرسن، فإن حجم هذا التأثير يكون ضئيلًا.
الآثار الجانبية الخطيرة لدواء فيونديز 53، وفقًا لـ FDA
في ديسمبر 2019، وافقت اللجنة الاستشارية FDA على دواء فيونديس 53 من شركة ساريبتا كأول خيار علاجي مُوجَّه لمرضى دوشين العضلي المعرضين لتخطي الإكسون 53. إلا أن اللجنة الاستشارية FDA رفضت الدواء قبل أربعة أشهر في طلب ترخيص موقّع من إليس أونغر، رئيس مكتب تقييم الأدوية في مركز تقييم الأدوية والبحث آنذاك.
ذكرت دراسة FDA في تبريرها للرفض أنه بالنظر إلى "الزيادة الطفيفة في الديستروفين المبتور" التي أحدثها العلاج، فإن التأثير العلاجي لدواء فيونديز 53 سيكون على الأرجح "ضئيلًا نسبيًا". وتابع أنغر موضحًا أنه "لا توجد علاقة" بين كمية الديستروفين التي أنتجها دواء فيونديز 53 لدى الأولاد وأدائهم البدني، وأن "جميعهم تقريبًا" الذين خضعوا للفحص بعد تلقي الدواء أظهروا فقدانًا متزايدًا في الوظائف البدنية.
كما لو أن الكدمات لم تكن كافية، سرد أنغر قائمة طويلة من المخاوف المتعلقة بالسلامة التي واجهها مستخدمو فيونديز 53. وشملت هذه المخاوف "التسمم الكلوي" و"الالتهابات الخطيرة المرتبطة بتوصيل الدواء". ويزعم أن كليهما "قد يكون قاتلاً"، وأن الأخير "يصعب أو يستحيل رصده".
بالنظر إلى حالتي الوفاة الأخيرتين الناتجتين عن فشل كبدي حاد والمرتبطتين بالعلاج الجيني Elevidys من شركة ساريبتا، فإن هذا التحذير الثاني مثير للقلق بشكل خاص. وكما أشار أنغر في الرسالة، فقد ارتبط كلا المسارين بضرر كبدي، على الرغم من أن فيونديس 53 هو أوليجونوكليوتيد مضاد للاتجاه (ASO) على عكس العلاج الجيني القائم على فيروس الغدة الدرقية المرتبط (AAV) مثل Elevidys.
اقرأ المزيد: خطاب رفض Vyondys 53 FDA
كيف تمت الموافقة على Vyondys 53؟
لمعالجة المخاوف التي أثارتها الهيئة التنظيمية في CRL، قدمت شركة Sarepta لاحقًا استئنافًا واجتمعت مع FDA. وأدى ذلك في النهاية إلى موافقة بيتر شتاين، رئيس مكتب الأدوية الجديدة في FDA آنذاك، والذي غادر الوكالة في أبريل، على عقار Vyondys 53.
شركات الأدوية لا تنشر جميع المعلومات
قال الدكتور مارتي ماكاري، مفوض FDA، الحاصل على ماجستير الصحة العامة، "لطالما اعتمد مطورو الأدوية على التخمين عند التعامل مع FDA". وأضاف: "يسعى مطورو الأدوية وأسواق رأس المال على حد سواء إلى تحقيق القدرة على التنبؤ. لذا، نقترب اليوم خطوة أخرى من تحقيق ذلك، بهدفنا النهائي المتمثل في توفير علاجات ناجعة للمرضى بشكل أسرع".
لأن FDA امتنعت تاريخيًا عن نشر قوائم إلغاء الشهادات (CRLs) للطلبات قيد الانتظار، فإن الجهات الراعية غالبًا ما تُسيء تفسير الأساس المنطقي وراء قرار FDA لأصحاب المصلحة والجمهور. ووفقًا لتحليل أجراه باحثو FDA عام 2015، تجنبت الجهات الراعية ذكر مخاوف FDA بشأن السلامة والفعالية عند الإعلان علنًا عن رفض طلبها. علاوة على ذلك، عندما تدعو FDA إلى إجراء تجربة سريرية جديدة للتحقق من السلامة أو الفعالية، لا يتم الكشف عن هذه المعلومات المهمة في أغلب الأحيان. كما لا تتم مشاركة الدروس المستفادة من عدم الموافقة داخل الصناعة، مما يدفع الشركات إلى ارتكاب أخطاء مماثلة بشكل متكرر. - اقرأ المزيد: FDA يتبنى الشفافية الجذرية من خلال نشر رسائل الرد الكاملة –