El proceso de desarrollo de fármacos es un proceso complejo, largo y costoso que dura muchos años, generalmente entre 10 y 15, desde el descubrimiento inicial hasta su comercialización. Incluyendo las curas para la distrofia muscular de Duchenne, comprende varias etapas, cada una cuidadosamente diseñada para evaluar la seguridad, la eficacia y los posibles riesgos de un nuevo fármaco antes de su comercialización. Las etapas del desarrollo de fármacos se dividen en investigación preclínica y ensayos clínicos, que son el foco principal de agencias reguladoras como la Administración de Alimentos y Medicamentos (FDA) (FDA) y la Agencia Europea de Medicamentos (EMA).
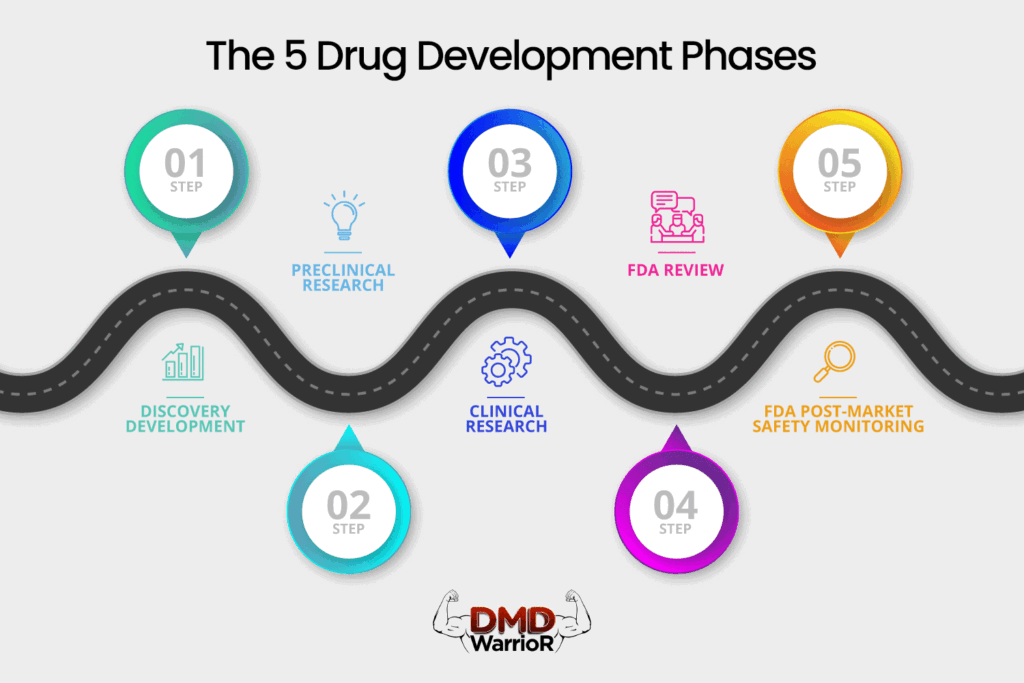
Un nuevo medicamento debe pasar por cinco etapas distintas para ser considerado un “éxito”: 1) Descubrimiento y desarrollo; 2) Investigación preclínica; 3) Ensayos clínicos; 4) Revisión del fármaco; y 5) Monitoreo de seguridad posterior a la comercialización.FDA]
Tabla de contenido
Descubrimiento y desarrollo
Antes incluso de que un fármaco entre en la fase de ensayos clínicos, se lleva a cabo una importante investigación preliminar. Esta fase incluye:
- Descubrimiento de fármacosEl primer paso consiste en identificar una diana biológica (como una proteína o un gen) implicada en una enfermedad. Los científicos pueden analizar grandes bibliotecas de compuestos para identificar candidatos que puedan afectar a la diana. Estos compuestos se optimizan para mejorar su eficacia y reducir los posibles efectos secundarios.
Investigación preclínica
- Preclínico: Una vez identificado un compuesto prometedor, se somete a pruebas de laboratorio in vitro (fuera de un organismo vivo) e in vivo (en organismos vivos, generalmente animales) para evaluar su toxicidad, farmacocinética (cómo se absorbe, distribuye, metaboliza y excreta el fármaco en el organismo) y farmacodinámica (cómo afecta el fármaco al organismo). Estos estudios ayudan a determinar si el fármaco es seguro y eficaz en humanos.
- Estudios de toxicología: Durante la investigación preclínica, los científicos realizan estudios detallados para evaluar los posibles efectos nocivos del fármaco. El objetivo es identificar la dosis máxima tolerada y cualquier efecto adverso que pueda presentarse.
Si los estudios preclínicos tienen éxito, el medicamento pasa a la fase de ensayos clínicos, que implica probar el fármaco en humanos.
Ensayos clínicos
¿Qué son los ensayos clínicos de fase 1, fase 2 y fase 3?
El proceso de ensayo clínico se divide en cuatro fases distintas (Fase 1, Fase 2, Fase 3 y Fase 4) para evaluar progresivamente la seguridad, la eficacia y la relación beneficio-riesgo de un fármaco en humanos. Cada fase cumple una función específica en el proceso de evaluación.
Fase 1: Seguridad y dosificación
La fase 1 es la primera vez que el fármaco se prueba en humanos tras la investigación preclínica. El objetivo principal de los ensayos de fase 1 es evaluar el perfil de seguridad del fármaco, determinar un rango de dosificación seguro e identificar posibles efectos secundarios.
- Diseño del estudioNormalmente, los ensayos de fase 1 son pequeños, con la participación de entre 20 y 100 voluntarios sanos o personas con la enfermedad o afección. Estos ensayos suelen realizarse en un entorno clínico controlado, como un hospital o un centro de investigación.
- Objetivos:
- SeguridadLos investigadores vigilan de cerca a los voluntarios para detectar cualquier efecto adverso, desde síntomas leves hasta reacciones más graves.
- DosificaciónLa dosis inicial del fármaco suele ser conservadora. La dosis se aumenta gradualmente mediante un proceso conocido como escalada de dosis para determinar la dosis máxima tolerada.
- Farmacocinética y farmacodinamiaLos investigadores también estudian cómo el fármaco se absorbe, se distribuye, se metaboliza y se excreta en el organismo, así como sus efectos biológicos.
- DuraciónLos ensayos de fase 1 suelen durar unos meses. Si tienen éxito, el fármaco pasa a la fase 2.
Fase 2: Eficacia y efectos secundarios
Los ensayos de fase 2 se llevan a cabo para investigar más a fondo la eficacia y seguridad del medicamento en una población específica de pacientes que padecen la enfermedad o afección que el medicamento pretende tratar.
- Diseño del estudioEstos ensayos suelen ser más amplios que la Fase 1, con la participación de entre 100 y 300 participantes. El objetivo es evaluar la eficacia del fármaco en pacientes e identificar cualquier efecto adverso asociado con el uso a largo plazo.
- Objetivos:
- EficaciaLos investigadores buscan determinar si el fármaco produce el efecto terapéutico deseado en pacientes con la afección en cuestión. La eficacia se mide mediante resultados clínicos, como la mejoría de los síntomas o los biomarcadores de la enfermedad.
- Seguridad:De manera similar a la Fase 1, los investigadores continúan monitoreando la seguridad, pero el objetivo principal es identificar cualquier efecto secundario que pueda surgir en pacientes con la enfermedad.
- Dosis óptimaDurante la Fase 2, los investigadores perfeccionan aún más el régimen de dosificación del medicamento basándose en la información obtenida en la Fase 1.
- DuraciónLos ensayos de fase 2 suelen durar entre varios meses y algunos años. Si el fármaco muestra eficacia y un perfil de seguridad favorable, avanza a la fase 3.
Fase 3: Ensayos confirmatorios (eficacia y seguridad)
Los ensayos de fase 3 son estudios a gran escala diseñados para confirmar la eficacia del fármaco, monitorizar sus efectos secundarios y compararlo con tratamientos existentes o con un placebo. Esta fase desempeña un papel fundamental para determinar si las autoridades reguladoras deben aprobar el uso del fármaco.
- Diseño del estudioLos ensayos de fase 3 involucran a un número mucho mayor de participantes, que suelen oscilar entre 1000 y 3000 o más. Estos ensayos suelen ser multicéntricos, lo que significa que se realizan en múltiples ubicaciones y, a veces, incluso a nivel internacional.
- Objetivos:
- Eficacia:El objetivo es confirmar que el medicamento proporciona un beneficio clínicamente significativo respecto a los tratamientos existentes o un placebo.
- SeguridadLos investigadores continúan monitoreando los efectos secundarios, pero el mayor tamaño de muestra ayuda a identificar eventos adversos menos comunes que podrían haber pasado desapercibidos en fases anteriores.
- Efectividad comparativa:Los ensayos de fase 3 a menudo comparan el nuevo fármaco con tratamientos estándar o placebos para demostrar su superioridad o no inferioridad.
- DuraciónLos ensayos de fase 3 pueden durar varios años debido a la extensa recopilación de datos requerida. Estos ensayos suelen ser la parte más costosa y lenta del proceso de desarrollo de fármacos.
- Resultado finalSi un ensayo de fase 3 tiene éxito, el patrocinador del fármaco puede presentar una Solicitud de Nuevo Medicamento (NDA) o una Solicitud de Licencia de Biológicos (BLA) ante las autoridades reguladoras, como la FDA o la EMA. Si se aprueba, el fármaco pasa a la fase final. Fase 4.
Reseña del medicamento FDA
Los resultados de seguridad y eficacia de un fármaco obtenido en ensayos clínicos son revisados por un panel de especialistas que incluye médicos, químicos, estadísticos, microbiólogos y farmacólogos una vez que el fármaco ha pasado las fases 1, 2, 3 y 4 de los ensayos clínicos.
Una empresa biotecnológica o farmacéutica debe presentar una Solicitud de Licencia de Biológicos (BLA) para productos biológicos o una Solicitud de Nuevo Medicamento (NDA) para medicamentos para solicitar la evaluación del FDA. Posteriormente, el FDA debe aprobar la solicitud y designar un grupo de profesionales para evaluar sus méritos.
El grupo examina conjuntamente el estudio clínico, considerando el análisis de riesgos y beneficios del medicamento, los posibles efectos secundarios y los resultados en los pacientes. El FDA autoriza la fabricación, comercialización y distribución del medicamento en EE. UU. si se considera seguro y eficaz para el uso previsto.
Monitoreo de seguridad poscomercialización del FDA
Una vez que un medicamento es aprobado por las agencias reguladoras, entra en la fase posterior a la comercialización, también conocida como Fase 4. En esta fase, el medicamento está disponible para su uso por parte de la población general, pero los investigadores continúan monitoreando su seguridad a largo plazo, su eficacia y cualquier efecto secundario raro o de largo plazo.
- Vigilancia posterior a la comercialización:En la Fase 4, los estudios en curso y los informes de los pacientes (por ejemplo, los de los sistemas de notificación de eventos adversos) ayudan a identificar cualquier efecto secundario raro que podría no haberse detectado durante ensayos anteriores.
- Datos del mundo realLos investigadores también recopilan datos sobre el rendimiento del medicamento en entornos del mundo real y en diversas poblaciones que pueden no haber estado adecuadamente representadas en los ensayos clínicos.
Más información: Curas de Duchenne (Lista de todas las investigaciones)
Conclusión: La importancia de cada fase en el desarrollo de fármacos
Cada fase del desarrollo clínico de un fármaco desempeña un papel crucial para garantizar su seguridad y eficacia antes de su comercialización. Desde la Fase 1, donde la seguridad es la prioridad, hasta la Fase 3, que evalúa rigurosamente la relación beneficio-riesgo general de un fármaco en una amplia población de pacientes, y la Fase 4, que monitoriza los efectos a largo plazo tras su comercialización, cada fase contribuye a comprender mejor el impacto del fármaco en los pacientes.
El proceso general de desarrollo de fármacos es un complejo equilibrio, ya que compañías farmacéuticas, organismos reguladores e investigadores trabajan juntos para comercializar tratamientos innovadores que transformen vidas, minimizando al mismo tiempo los posibles daños. El tiempo, el esfuerzo y los costos invertidos en el desarrollo de fármacos son considerables, pero son esenciales para el avance de la ciencia médica y la mejora de los resultados de los pacientes en todo el mundo.



